Cum sunt implicate substanțele în gluconeogeneză? Sinteza glucozei din aminoacizi Gluconeogeneza din acidul glutamic
De la sânge la celulele țesuturilor, glucoza intră prin mecanismul difuziei facilitate cu participarea proteinelor purtătoare. Excepție fac celulele musculare și ale țesutului adipos, unde difuzia facilitată este reglată de insulină (hormonul pancreatic). În absența insulinei, membrana plasmatică a acestor celule este impermeabilă la glucoză, deoarece nu conține proteine purtătoare de glucoză.
Transportoare de glucoză(GLUT) se găsesc în toate țesuturile.
|
Tipuri de GLUT |
Localizare în organe |
|
În principal în creier, placentă, rinichi, intestinul gros |
|
|
În principal în ficat, rinichi, celulele β ale insulelor Langerhans, enterocite |
|
|
În multe țesuturi, inclusiv creier, placentă, rinichi |
|
|
În mușchi (scheletici, cardiaci), țesutul adipos |
|
|
(dependent de insulină) |
Conținut în absența insulinei aproape complet în citoplasmă |
|
În intestinul subțire. Posibil un purtător de fructoză. |
Cele 5 tipuri de GLUT descrise au o structură primară și o organizare a domeniului similare.
GLUT-1 asigură un flux constant de glucoză către creier;
GLUT-2 se găsește în celulele organelor care eliberează glucoză în sânge. Cu participarea GLUT-2, glucoza este transferată în sânge din enterocite și ficat. GLUT-2 este implicat în transportul glucozei către celulele β ale pancreasului;
GLUT-3 are o afinitate mai mare pentru glucoză decât GLUT-1. De asemenea, asigură un flux constant de glucoză către celulele țesuturilor nervoase și ale altor țesuturi;
GLUT-4 este principalul transportator al glucozei către celulele musculare și ale țesutului adipos;
GLUT-5 se găsește în principal în celulele intestinului subțire. Funcțiile sale nu sunt bine cunoscute.
Toate tipurile de GLUT pot fi găsite atât în membrana plasmatică, cât și în veziculele membranare din citoplasmă. Cu toate acestea, numai GLUT-4, localizat în veziculele citoplasmatice, este încorporat în membrana plasmatică a celulelor musculare și adipoase cu participarea hormonului pancreatic insulină. Datorită faptului că furnizarea de glucoză a mușchilor și țesutului adipos depinde de insulină, aceste țesuturi sunt numite dependente de insulină.
Efectul insulinei asupra mișcării transportatorilor de glucoză de la citoplasmă la membrana plasmatică.
1 - legarea insulinei de receptor; 2 - secțiunea receptorului de insulină orientată spre interiorul celulei stimulează mișcarea transportatorilor de glucoză; 3, 4 - transportorii din compoziția veziculelor care le conțin se deplasează în membrana plasmatică a celulei, sunt incluși în compoziția acesteia și transferă glucoza în celulă.
Sunt cunoscute diverse nereguli în activitatea transportatorilor de glucoză. Un defect moștenit al acestor proteine poate sta la baza diabetului zaharat non-insulino-dependent. Disfuncțiile GLUT-4 sunt posibile în următoarele etape:
transmiterea semnalului de insulină despre mișcarea acestui transportor către membrană;
mișcarea transportorului în citoplasmă;
includerea în compoziția membranei;
desprinderea de membrană etc.
Gluconeogeneza este o sinteză glucoză din componente non-carbohidrate: lactat, piruvat, glicerol, acizi ceto ciclul Krebs și alți acizi ceto, din aminoacizi... Toți aminoacizii, cu excepția leucinei și lizinei cetogenice, sunt capabili să participe la sinteza glucozei. Atomii de carbon ai unora dintre ei (glucogeni) sunt complet incorporati in molecula de glucoza, unii (mixti) partial.
Pe lângă obținerea glucozei, gluconeogeneza asigură și curățarea lactat formată constant în celulele roșii din sânge sau în timpul lucrului muscular și glicerol, care este un produs al lipolizei în țesutul adipos.
După cum știți, în glicoliza Există trei reacții ireversibile: piruvat kinaza(al zecelea), fosfofructokinaza(al treilea) și hexokinaza(primul). În aceste reacții, se eliberează energie pentru sinteza ATP. Prin urmare, în procesul invers, bariere energetice, pe care celula o ocolește cu ajutorul unor reacții suplimentare.
Gluconeogeneza include totul reacții reversibile glicoliză și soluții speciale, adică nu reproduce complet reacția de oxidare a glucozei. Reacțiile sale sunt capabile să aibă loc în toate țesuturile, cu excepția ultimei reacții de glucoză-6-fosfatază, care are loc numai în ficatși rinichi... Prin urmare, strict vorbind, gluconeogeneza are loc numai în aceste două organe.
În această etapă a gluconeogenezei, funcționează două enzime cheie - în mitocondrii piruvat carboxilază iar în citosol fosfoenolpiruvat carboxikinaza,în acest caz, reacțiile consumă doi macroergi - ATP și GTP.
Din punct de vedere chimic, soluția pentru a zecea reacție pare destul de simplă:
O versiune simplificată a bypass-ului celei de-a zecea reacții de glicoliză
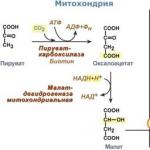
Cu toate acestea, ideea este că piruvat carboxilază este situat în mitocondrie și - în citosol. Completează problema impermeabilitate membrana mitocondrială pt oxalacetat... Dar prin membrană poate trece malat, un precursor al oxaloacetatului prin CTA.
Prin urmare, în realitate, totul pare mai complicat:
1. În citosol, acidul piruvic poate apărea în timpul oxidării acid lactic iar în reacţia de transaminare alanina... După aceea, piruvatul, cu ionii H + care se deplasează de-a lungul gradientului de protoni, pătrunde în mitocondrii. În mitocondrii piruvat carboxilază transformă acidul piruvic în oxalacetat.
Reacția piruvat carboxilază are loc constant în celulă, deoarece oxalacetatul este principalul regulator al ratei CTX. Reacția se numește răspuns anaplerotic (de completare) CTX.
2. În plus, oxalacetatul ar putea fi transformat în fosfoenolpiruvat, dar pentru aceasta trebuie mai întâi să intre în citosol. Prin urmare, reacția de reducere a oxaloacetatului la malat are loc cu participarea malat dehidrogenază... Ca urmare, malatul se acumulează, intră în citosol și aici este transformat înapoi în oxalacetat.
Excesul de NADH în mitocondrii permite inversarea reacției malat dehidrogenazei a CTX. NADH provine din β-oxidarea acizilor grași, care este activat în hepatocit în timpul postului.
3. În citoplasmă fosfoenolpiruvat carboxikinaza realizează transformarea oxalacetatului în fosfoenolpiruvat, reacția necesită energia GTP. Același carbon este separat de moleculă pe măsură ce este atașat.

Ocolind a zecea reacție de glicoliză
Ocolind a treia reacție de glicoliză
Al doilea obstacol în calea sintezei glucozei - reacția fosfofructokinazei - este depășit cu ajutorul unei enzime fructoză-1,6-difosfatază... Această enzimă se găsește în rinichi, ficat, mușchii striați. Astfel, aceste țesuturi sunt capabile să sintetizeze fructoză-6-fosfat și glucoză-6-fosfat.
Gluconeogeneza este un proces de sinteză a glucozei din substanțe non-carbohidrate. La mamifere, această funcție este îndeplinită în principal de ficat , într-o măsură mai mică - rinichi și celulele mucoasei intestinale ... Principalele substraturi ale gluconeogenezei sunt piruvat, lactat, glicerină, aminoacizi (Fig. 10).
Figura 10
Gluconeogeneza asigură necesarul de glucoză al organismului în cazurile în care dieta conține o cantitate insuficientă de carbohidrați (activitate fizică, post). O aprovizionare constantă cu glucoză este necesară în special pentru sistemul nervos și celulele roșii din sânge. Când concentrația de glucoză din sânge scade sub un anumit nivel critic, funcționarea creierului este perturbată; în hipoglicemia severă, apare o comă și poate fi fatală.
Organismul are suficiente rezerve de glicogen pentru a satisface necesarul de glucoză între mese. Cu carbohidrați sau foamete completă, precum și în condiții de muncă fizică prelungită, concentrația de glucoză în sânge este menținută datorită gluconeogenezei. Acest proces poate implica substanțe care sunt capabile să se transforme în piruvat sau orice alt metabolit al gluconeogenezei. Figura arată punctele de includere a substraturilor primare în gluconeogeneză:
Glucoza este esențială pentru țesutul adipos ca sursă de glicerol, care face parte din gliceride; joacă un rol esențial în menținerea concentrațiilor eficiente de metaboliți ai ciclului acidului citric în multe țesuturi. Chiar și în condițiile în care majoritatea necesarului de calorii al organismului este satisfăcut de grăsimi, întotdeauna există o anumită nevoie de glucoză.În plus, glucoza este singurul combustibil pentru funcționarea mușchilor scheletici în condiții anaerobe. Este un precursor al zahărului din lapte (lactoză) în glandele mamare și este consumat activ de către făt în timpul dezvoltării. Mecanismul gluconeogenezei este utilizat pentru a elimina din sânge produsele metabolismului tisular, de exemplu, lactatul, care se formează în mușchi și eritrocite, glicerolul, care se formează continuu în țesutul adipos.
Includerea diferitelor substraturi în gluconeogeneză depinde de starea fiziologică a organismului. lactat este un produs al glicolizei anaerobe în eritrocite și mușchii care lucrează. Glicerol eliberate în timpul hidrolizei grăsimilor din țesutul adipos în perioada postabsorbtivă sau în timpul efortului fizic. Aminoacizi se formează ca urmare a defalcării proteinelor musculare.
Șapte reacții de glicoliză sunt ușor reversibile și sunt utilizate în gluconeogeneză. Dar trei reacții kinazei sunt ireversibile și trebuie să fie șuntate (Fig. 12). Astfel, fructoza-1,6-difosfatul și glucoza-6-fosfatul sunt defosforilate de către fosfataze specifice, iar piruvatul este fosforilat pentru a forma fosfoenolpiruvat prin două etape intermediare prin oxalacetat. Formarea oxaloacetatului este catalizată de piruvat carboxilază. Această enzimă conține biotină ca coenzimă. Oxaloacetatul se formează în mitocondrii, este transportat în citosol și este implicat în gluconeogeneză. Trebuie remarcat faptul că fiecare dintre reacțiile ireversibile de glicoliză, împreună cu reacția ireversibilă corespunzătoare a gluconeogenezei, constituie un ciclu numit substrat:
Figura 12
Există trei astfel de cicluri - corespunzând la trei reacții ireversibile. Aceste cicluri servesc punctele de aplicare a mecanismelor de reglementare , în urma căreia fluxul de metaboliți se modifică fie pe calea defalcării glucozei, fie pe calea sintezei acesteia.
Direcția reacțiilor primul ciclu de substrat reglată în principal de concentrația de glucoză. În timpul digestiei, concentrația de glucoză din sânge crește. Activitatea glucokinazei este maximă în aceste condiții. Ca urmare, reacția glicolitică este accelerată. glucose ® glucoză-6-fosfat.În plus, insulina induce sinteza glucokinazei și prin urmare accelerează fosforilarea glucozei. Deoarece glucokinaza hepatică nu este inhibată de glucoză-6-fosfat (spre deosebire de hexokinaza musculară), cea mai mare parte a glucozei-6-fosfat este direcționată de-a lungul căii glicolitice.
Conversia glucozei-6-fosfatului în glucoză este catalizată de o altă fosfatază specifică - glucozo-6-fosfataza. Este prezent în ficat și rinichi, dar este absent în țesutul muscular și adipos. Prezența acestei enzime permite țesutului să furnizeze glucoză în sânge.
Descompunerea glicogenului cu formarea de glucoză-1-fosfat este efectuată de fosforilază. Sinteza glicogenului urmează o cale complet diferită, prin formarea de uridin difosfat glucoză, și este catalizată glicogen sintetaza.
Al doilea substrat ciclu: conversia fructoză-1,6-bifosfat în fructoză-6-fosfat, catalizată de o enzimă specifică fructoza-1,6-bisfosfataza. Această enzimă se găsește în ficat și rinichi și a fost găsită și în mușchii striați.
Direcția reacțiilor al doilea substrat ciclul depinde de activitatea fosfofructokinazei și a fosfatazei fructozei-1,6-bisfosfatului. Activitatea acestor enzime depinde de concentrația de fructoză-2,6-bisfosfat.
Fructoza-2,6-bifosfatul se formează prin fosforilarea fructozei-6-fosfatului cu participarea unei enzime bifuncționale (BIF), care catalizează, de asemenea, reacția inversă.
Activitatea kinazei are loc atunci când enzima bifuncțională este într-o formă defosforilată (BIF-OH). Forma defosforilată a BIF este caracteristică perioadei de absorbție, când indicele insulină-glucagon este ridicat.
Cu un indice de insulină-glucagon scăzut, caracteristic unei perioade de post prelungit, are loc fosforilarea BIF și manifestarea activității sale fosfatazei, ceea ce are ca rezultat o scădere a cantității de fructoză-2,6-bisfosfat, încetinirea glicolizei și trecerea la gluconeogeneza.
Reacțiile kinazei și fosfatazei sunt catalizate de diferiți centri activi ai BIF, dar în fiecare dintre cele două stări ale enzimei - fosforilat și defosforilat - unul dintre centrii activi este inhibat.
16.2.1. Gluconeogeneza este biosinteza glucozei din diverși compuși non-carbohidrați. Rolul biologic al gluconeogenezei este de a menține un nivel constant al glucozei din sânge, care este necesar pentru alimentarea normală cu energie a țesuturilor, care se caracterizează printr-o nevoie continuă de carbohidrați. Acest lucru este valabil mai ales pentru sistemul nervos central.
Rolul gluconeogenezei crește cu aportul insuficient de carbohidrați din alimente. Deci, în corpul unei persoane înfometate, se pot sintetiza până la 200 g de glucoză pe zi. Gluconeogeneza răspunde mai rapid decât alte procese metabolice la modificările dietei: introducerea unor cantități mari de proteine și grăsimi cu alimente activează procesele de gluconeogeneză; un exces de carbohidrați, dimpotrivă, inhibă formarea glucozei.
Activitatea fizică intensă este însoțită de o epuizare rapidă a rezervelor de glucoză din organism. În acest caz, gluconeogeneza este modalitatea principală de completare a resurselor de carbohidrați, prevenind dezvoltarea hipoglicemiei. Gluconeogeneza din organism este, de asemenea, strâns legată de procesele de neutralizare a amoniacului și de menținere a echilibrului acido-bazic.
16.2.2. Locul principal al biosintezei glucozei de novo este ficatul. Gluconeogeneza are loc și în cortexul renal. Este general acceptat că contribuția rinichilor la gluconeogeneză în condiții fiziologice este de aproximativ 10% din glucoza sintetizată în organism; în condiții patologice, această proporție poate crește semnificativ. Activitatea nesemnificativă a enzimelor gluconeogenezei a fost găsită în membrana mucoasă a intestinului subțire.
16.2.3. Secvența reacțiilor de gluconeogeneză este inversarea reacțiilor corespunzătoare de glicoliză. Doar trei reacții de glicoliză sunt ireversibile din cauza schimbărilor semnificative de energie care au loc în cursul lor:
a) fosforilarea glucozei; b) fosforilarea fructozei-6-fosfatului; c) conversia fosfoenolpiruvatului în piruvat.Ocolirea acestor bariere energetice este asigurată de enzimele cheie ale gluconeogenezei.
Conversia inversă a piruvatului în fosfoenolpiruvat necesită participarea a două enzime. Primul este piruvat carboxilază - catalizează reacţia de formare a oxaloacetatului (Figura 16.4, reacţia 1). Coenzima piruvat carboxilazei este biotina (vitamina H). Reacția rulează în mitocondrii. Rolul său este, de asemenea, de a reface fondul de oxaloacetat pentru ciclul Krebs.
Toate reacțiile ulterioare de gluconeogeneză au loc citoplasma ... Membrana mitocondrială este impermeabilă la oxaloacetat și este transferată în citoplasmă sub formă de alți metaboliți: malat sau aspartat. În citoplasmă, acești compuși sunt transformați din nou în oxalacetat. În rolurile principale fosfoenolpiruvat carboxikinaza din oxaloacetat se formează fosfoenolpiruvat (Figura 16.4, reacția 2).
Fosfoenolpiruvatul este transformat în fructoză-1,6-difosfat ca rezultat al inversării unui număr de reacții de glicoliză. Conversia fructoză-1,6-difosfat în fructoză-6-fosfat este catalizată de fructoză difosfatază (Figura 16.4, reacția 3).
Fructoza-6-fosfatul este izomerizat la glucoză-6-fosfat. Reacția finală a gluconeogenezei este hidroliza glucozei-6-fosfatului cu participarea enzimei glucozo-6-fosfatazei (Figura 16.4, reacția 4).
Figura 16.4. Reacții de bypass de gluconeogeneză .
16.2.4. Principalele surse de glucoză în gluconeogeneză sunt lactatul, aminoacizii, glicerolul și metaboliții ciclului Krebs.
lactat- produsul final al oxidării anaerobe a glucozei. Poate fi implicat în gluconeogeneză după oxidarea la piruvat în reacția lactat dehidrogenazei (vezi secțiunea „Glicoliza”, Figura 15.4, reacția 11). Cu munca fizică prelungită, principala sursă de lactat sunt mușchii scheletici, în celulele cărora predomină procesele anaerobe. Acumularea de acid lactic în mușchi limitează performanța acestora. Acest lucru se datorează faptului că odată cu creșterea concentrației de acid lactic în țesut, nivelul pH-ului scade (acidoză lactică). O modificare a pH-ului duce la inhibarea enzimelor celor mai importante căi metabolice. În eliminarea acidului lactic rezultat, un loc important îi revine Ciclul Corey glucoză-lactat (Figura 16.5).

Figura 16.5. Ciclul Corey și ciclul glucoză-alanină (a se vedea textul pentru explicații).
Aminoacizi glucogenici, care includ majoritatea aminoacizilor proteici. Locul principal în gluconeogeneză printre aminoacizi îi aparține Alanin , care poate fi transformat în piruvat prin transaminare. În timpul postului, a muncii fizice și a altor condiții din organism, funcționează ciclul glucoza-alanina similar cu ciclul Corey pentru lactat (Figura 16.2). Existența ciclului alanină-glucoză previne otrăvirea organismului, deoarece nu există enzime în mușchi care utilizează amoniacul. Ca urmare a antrenamentului, puterea acestui ciclu crește semnificativ.
Alți aminoacizi, cum ar fi alanina, pot fi transformați în piruvat și, de asemenea, în produse intermediare ale ciclului Krebs (α-cetoglutarat, fumarat, succinil-CoA). Toți acești metaboliți sunt capabili să fie transformați în oxaloacetat și implicați în gluconeogeneză.
Glicerol- un produs al hidrolizei lipidelor în țesutul adipos. Acest proces este mult îmbunătățit de post. În ficat, glicerolul este transformat în dioxiacetonă fosfat, un produs intermediar al glicolizei, și poate fi utilizat în gluconeogeneză.
Acid gras și acetil-CoA nu sunt precursori de glucoză. Oxidarea acestor compuși oferă energie pentru sinteza glucozei.
16.2.5. Bilanțul energetic. Calea pentru sinteza glucozei din piruvat (Figura 16.6) conține trei reacții, însoțite de consumul de energie ATP sau GTP:
a) formarea de oxalacetat din piruvat (se consumă molecula de ATP); b) formarea fosfoenolpiruvatului din oxaloacetat (se consumă molecula GTP); c) inversarea fosforilării primului substrat - formarea de 1,3-difosfoglicerat din 3-fosfoglicerat (se consumă molecula de ATP).Fiecare dintre aceste reacții se repetă de două ori, deoarece 2 molecule de piruvat (C3) sunt folosite pentru a forma 1 moleculă de glucoză (C6). Prin urmare, bilanțul energetic al sintezei glucozei din piruvat este de - 6 molecule de nucleozide trifosfați (4 molecule ATP și 2 molecule GTP). Când sunt utilizați alți precursori, echilibrul energetic al biosintezei glucozei este diferit.

Figura 16.6. Bilanțul energetic al biosintezei glucozei din lactat.
16.2.6. Reglarea gluconeogenezei. Rata gluconeogenezei este determinată de disponibilitatea substraturilor precursoare de glucoză. O creștere a concentrației sanguine a oricăruia dintre precursorii de glucoză duce la stimularea gluconeogenezei.
Unii metaboliți sunt efectori alosterici ai enzimelor de gluconeogeneză. De exemplu, acetil-CoA la concentrații crescute activează alosteric piruvat carboxilaza, care catalizează prima reacție de gluconeogeneză. Adenozin monofosfatul, dimpotrivă, are un efect inhibitor asupra fructozei difosfatazei, iar un exces de glucoză inhibă glucozo-6-fosfataza.
Hormonul pancreatic glucagon, hormonii suprarenalii adrenalina și cortizolul cresc rata de biosinteză a glucozei în organism, crescând activitatea enzimelor cheie de gluconeogeneză sau crescând concentrația acestor enzime în celule. Hormonul pancreatic insulina ajută la reducerea ratei gluconeogenezei în organism.
În piruvat sau unul dintre produșii intermediari ai ciclului acidului tricarboxilic.
La vertebrate, gluconeogeneza are loc cel mai intens în celulele ficatului și rinichilor (în cortex).
Prima etapă a sintezei are loc în mitocondrii (Fig. 10.6). Piruvat carboxilaza, care catalizează această reacție, este o enzimă mitocondrială alosterică. Acetil-CoA este necesar ca activator alosteric al acestei enzime. Membrana mitocondrială este impermeabilă la oxalacetatul format. Acesta din urmă aici, în mitocondrii, este redus la malat:


Conversia ulterioară a oxaloacetatului în fosfoenolpiruvat are loc în citosolul celulei.
Transformarea fructozei 1,6-bifosfat în fructoză-6-fosfat... Fosfo-enolpiruvatul, format din piruvat, este transformat în fructoză-1,6-bisfosfat ca urmare a unei serii de reacții de glicoliză reversibile. Aceasta este urmată de o reacție de fosfofructokinază, care este ireversibilă. Gluconeogeneza ocolește această reacție endergonică. Conversia fructoze-1,6-bis-fosfat în fructoză-6-fosfat este catalizată de o fosfatază specifică:

Orez. 10.6. Formarea piruvatului de fosfoenol din piruvat. 1 - piruvat carboxilază; 2 - malat dehidrogenaza (mitocondrială); 3-malat dehidrogenază (citoplasmatică); 4 - fosfoenolpiruvat carboxi kinaza.

Un alt punct important în reglarea gluconeogenezei este reacția catalizată de fructoză-1,6-bisfosfatază, o enzimă care este inhibată de AMP. AMP are efectul opus asupra fosfofructokinazei, adică pentru această enzimă este un activator alosteric. Cu o concentrație scăzută de AMP și un nivel ridicat de ATP, gluconeogeneza este stimulată. Dimpotrivă, atunci când valoarea raportului ATP / AMP este mică, se observă descompunerea glucozei în celulă.
În 1980, un grup de cercetători belgieni (G. Hers și alții) a descoperit fructoză-2,6-bisfosfat în țesutul hepatic, care este un regulator puternic al activității celor două enzime enumerate:

Fructoza-2,6-bisfosfatul activează fosfofructokinaza și inhibă fructoza-1,6-bisfosfataza. O creștere a nivelului de fructoză-2,6-bis-fosfat în celulă promovează creșterea glicolizei și o scădere a ratei de gluconeogeneză. Cu o scădere a concentrației de fructoză-2,6-bisfosfat, se observă imaginea opusă.

De asemenea, s-a demonstrat că enzima bifuncțională, la rândul său, este reglată de fosforilarea dependentă de cAMP. Fosforilarea duce la o creștere a activității fosfatazei și la o scădere a activității fosfokinazei unei enzime bifuncționale. Acest mecanism explică efectul rapid al hormonilor, în special al glucagonului, asupra nivelului de fructoză-2,6-bifosfat din celulă (vezi capitolul 16).
Activitatea enzimei bifuncționale este, de asemenea, reglementată de unii