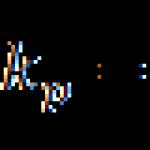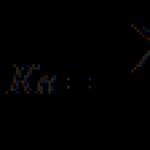تجارب المركبات الكيميائية. تجارب مسلية في الكيمياء
المعدات والكواشف: أكواب ، دورق مخروطي الشكل ، حامل معدني ، كوب خزفي ، آلة تبلور ، سكين ، صينية معدنية ، رفوف أنابيب الاختبار ، أنابيب اختبار ، أعواد ثقاب ، ملاقط ، ماصات ، منديل ؛ ماء ، وقود جاف ، 3 أقراص غلوكونات الكالسيوم ، كربونات البوتاسيوم ، أمونيا 25٪ ، حمض الهيدروكلوريك (محلول) ، فينول فثالين ، صوديوم معدني ، كحول ، غراء قرطاسية ، ثنائي كرومات الأمونيوم ، ثنائي كرومات البوتاسيوم ، حامض الكبريتيك ، بيروكسيد الهيدروجين ، محاليل كلوريد الحديديك (الثالث) ، KCNS ، فلوريد الصوديوم.
تقدم الحدث
الكيمياء هي علم مثير للاهتمام ورائع. بمساعدة الكيمياء ، تصبح حياتنا أكثر تشويقًا وتنوعًا.
بدون الكيمياء ، سيصبح العالم كله قاتمًا.
نحن نقود ونعيش ونطير بالكيمياء ،
نحن نعيش في أجزاء مختلفة من الأرض ،
نقوم بتنظيف ومسح وإزالة البقع ،
نحن نأكل وننام ونرتدي شعرنا.
نتعامل مع الكيمياء والغراء والخياطة
نحن نعيش جنبا إلى جنب مع الكيمياء!
بالرغم من عدم وجود معجزات في العالم.
تقدم الكيمياء الجواب.
"هناك معجزات في العالم.
وبالطبع هناك الكثير منهم! "
لا تنتهك نصيحة المعلمين:
وحتى لو لم تكن جبانًا ،
لا تتذوق المواد!
ولا تفكر في شمها.
نفهم أن هذه ليست زهور!
لا تأخذ أي شيء بيديك
سوف تحترق ، بثور!
شاي وشطيرة لذيذة
يسألون كثيرا عن فمك.
لا تكذب على نفسك -
لا يمكنك أن تأكل وتشرب معنا!
هذه غرفة كيميائية يا صديقي
لا توجد شروط للطعام.
في قارورة - مثل مربى البرتقال ،
لا تتذوق المواد!
حتى السم تفوح منه رائحة حلوة.
في غرفة الكيمياء
الكثير من الأشياء:
المخاريط وأنابيب الاختبار
قمع وحامل ثلاثي القوائم.
وأنت لا تحتاج إلى سحب
أقلام النفايات
ثم تسكبها بالصدفة
كاشف قيم!
"ثعابين فرعون"
التجربة: وضع قرص من الوقود الجاف على حامل ، وضع عليه 3 أقراص من جلوكونات الكالسيوم واشعال النار فيه. تتشكل كتلة رمادية فاتحة تشبه الثعبان.
"دخان بدون نار"
الخبرة: (يجب إجراء التجربة في غرفة جيدة التهوية أو في غطاء دخان) صب كربونات البوتاسيوم في دورق كبير (300-500 مل) بحيث يغطي قاعه بطبقة متساوية ، وأضف بعناية 25 ٪ محلول أمونيا بحيث يرطبها ... ثم ببطء (كن حذرًا!) صب القليل من حمض الهيدروكلوريك المركز في القارورة (يظهر "دخان" أبيض). ماذا نرى؟ لا يوجد دخان. كما ترى ، في الحياة لا يوجد دخان بدون نار ، لكن هذا يحدث في الكيمياء.
"لهب على الماء"
الخبرة: أضف الفينول فثالين إلى كوب من الماء. قطع قطعة من معدن الصوديوم أو الليثيوم ووضعها بعناية في الماء. يطفو المعدن على السطح ، ويشتعل الهيدروجين ، والقلويات الناتجة تجعل الماء يتحول إلى قرمزي.
"بركان"
الطبيعة العظيمة مليئة بالمعجزات ،
وعلى الأرض تخضع لها وحدها
النجوم الساطعة وغروب الشمس وشروق الشمس
هبوب الرياح وركوب الأمواج ...
لكننا الآن سترى بنفسك
أحيانًا نمتلك أيضًا المعجزات.
الخبرة: صب ثنائي كرومات الأمونيوم على صينية ، أضف الكحول ، أشعل النار فيه.
"وشاح مقاوم للحريق"
إجابات الأطفال).
طارت بساطتنا الطائرة بعيدًا
ليس لدينا التجميع الذاتي أيضًا ،
هناك منديل سوف يضيء الآن ،
لكن ، صدقوني ، لن تكون قادرة على الاحتراق.
التجربة: بلل منديلًا بمزيج من الغراء والماء (غراء سيليكات + ماء = 1: 1.5) ، ثم جففه قليلاً ، ثم رطب بالكحول واشعل النار فيه.
"برتقال ، ليمون ، تفاح"
التجربة: أولاً ، يُعرض على الجمهور كأس بمحلول ثنائي كرومات البوتاسيوم ، وهو برتقالي اللون. ثم يضاف القلوي ، فيتحول "عصير البرتقال" إلى "ليمون". ثم يتم عمل العكس: من "عصير الليمون" - "برتقالة" ، يتم إضافة القليل من حامض الكبريتيك ، ثم يضاف القليل من محلول بيروكسيد الهيدروجين ويصبح "العصير" "تفاحة".
"التئام الجروح"
هناك ثلاث قوارير على الطاولة: "اليود" (محلول FeCl3) ، "الكحول" (KCNS) ، "الماء الحي" (NaF).
هذه متعة أخرى لك
من يمد يده لقطع؟
إنه لأمر مؤسف أن يتم قطع اليد ،
ثم يحتاج المريض للعلاج!
نعمل بدون ألم.
الحقيقة ستكون الكثير من الدماء.
كل عملية تتطلب التعقيم.
مساعدة ، مساعد ،
أعط الكحول.
لحظة واحدة! (يعطي الكحول- KCNS)
سنشحم بالكحول بكثرة.
لا تستدير أيها المريض
أعطني مشرط ، مساعد!
("المبضع" عصا مغموسة في FeCl3)
انظر مباشرة في قطرة
الدم يتدفق وليس الماء.
ولكن الآن سوف أجفف يدي -
لا أثر للقطع!
"اليود" - محلول FeCl3 ، "كحول" - KCNS ، "ماء حي" - NaF.
"نحن سحرة"
حليب ملون.
عرض محتوى الوثيقة
"تجارب مسلية في الكيمياء"
تجارب مثيرة للاهتمام
في الكيمياء للأطفال
استهداف: عرض تجارب مثيرة للاهتمام في الكيمياء
مهام:
تحفيز الطلاب على دراسة الكيمياء ؛
لإكساب الطلاب المهارات الأولى في التعامل مع المعدات والمواد الكيميائية.
المعدات والكواشف: أكواب ، دورق مخروطي الشكل ، حامل معدني ، كوب خزفي ، آلة تبلور ، سكين ، صينية معدنية ، رفوف أنابيب الاختبار ، أنابيب اختبار ، أعواد ثقاب ، ملاقط ، ماصات ، منديل ؛ ماء ، وقود جاف ، 3 أقراص غلوكونات الكالسيوم ، كربونات البوتاسيوم ، أمونيا 25٪ ، حمض الهيدروكلوريك (محلول) ، فينول فثالين ، صوديوم معدني ، كحول ، غراء قرطاسية ، ثنائي كرومات الأمونيوم ، ثنائي كرومات البوتاسيوم ، حامض الكبريتيك ، بيروكسيد الهيدروجين ، محاليل كلوريد الحديديك (الثالث) ، KCNS ، فلوريد الصوديوم.
تقدم الحدث
الكيمياء هي علم مثير للاهتمام ورائع. بمساعدة الكيمياء ، تصبح حياتنا أكثر تشويقًا وتنوعًا.
بدون كيمياء الحياة صدقني لا
بدون الكيمياء ، سيصبح العالم كله قاتمًا.
نحن نقود ونعيش ونطير بالكيمياء ،
نحن نعيش في أجزاء مختلفة من الأرض ،
نقوم بتنظيف ومسح وإزالة البقع ،
نحن نأكل وننام ونرتدي شعرنا.
نتعامل مع الكيمياء والغراء والخياطة
نحن نعيش جنبا إلى جنب مع الكيمياء!
بالرغم من عدم وجود معجزات في العالم.
تقدم الكيمياء الجواب.
"هناك معجزات في العالم.
وبالطبع هناك الكثير منهم! "
ولكن قبل الشروع في الجزء العملي من الحدث ، استمع إلى القصة المصورة قوانين السلامه.
دخول غرفة الكيماويات لدينا ،
لا تنتهك نصيحة المعلمين:
وحتى لو لم تكن جبانًا ،
لا تتذوق المواد!
ولا تفكر في شمها.
نفهم أن هذه ليست زهور!
لا تأخذ أي شيء بيديك
سوف تحترق ، بثور!
شاي وشطيرة لذيذة
يسألون كثيرا عن فمك.
لا تكذب على نفسك -
لا يمكنك أن تأكل وتشرب معنا!
هذه غرفة كيميائية يا صديقي
لا توجد شروط للطعام.
دع رائحة الفوبلا في أنبوب الاختبار ،
في قارورة - مثل مربى البرتقال ،
لا تتذوق المواد!
حتى السم تفوح منه رائحة حلوة.
في غرفة الكيمياء
الكثير من الأشياء:
المخاريط وأنابيب الاختبار
قمع وحامل ثلاثي القوائم.
وأنت لا تحتاج إلى سحب
أقلام النفايات
ثم تسكبها بالصدفة
كاشف قيم!
"ثعابين فرعون"
في الهند ، في مصر ، يمكنك مشاهدة رقصات الثعابين على أنغام المذيعين. دعونا نحاول أن نجعل "الثعابين" ترقص ، فقط سيكون لدينا نار كمتعلم.
خبرة:ضع قرصًا من الوقود الجاف على الحامل ، وضع عليه 3 أقراص من جلوكونات الكالسيوم واشعل النار فيه. تتشكل كتلة رمادية فاتحة تشبه الثعبان.
"دخان بدون نار"
يقول المثل القديم "لا دخان بدون نار" ، فلنتحقق من ذلك.
خبرة: (يجب إجراء التجربة في غرفة جيدة التهوية أو في غطاء دخان) صب كربونات البوتاسيوم في دورق كبير (300-500 مل) بحيث يغطي قاعه بطبقة متساوية ، وأضف بعناية 25٪ محلول الأمونيا بحيث يرطبها. ثم ببطء (كن حذرًا!) صب القليل من حمض الهيدروكلوريك المركز في القارورة (يظهر "دخان" أبيض). ماذا نرى؟ لا يوجد دخان. كما ترى ، في الحياة لا يوجد دخان بدون نار ، لكن هذا يحدث في الكيمياء.
"لهب على الماء"
هل يمكنك قطع المعدن بالسكين؟ هل يمكنه السباحة؟ هل يمكن للماء أن يحترق؟
خبرة:أضف الفينول فثالين إلى كوب من الماء. قطع قطعة من معدن الصوديوم أو الليثيوم ووضعها بعناية في الماء. يطفو المعدن على السطح ، ويشتعل الهيدروجين ، والقلويات الناتجة تجعل الماء يتحول إلى قرمزي.
"بركان"
الطبيعة العظيمة مليئة بالمعجزات ،
وعلى الأرض تخضع لها وحدها
النجوم الساطعة وغروب الشمس وشروق الشمس
هبوب الرياح وركوب الأمواج ...
لكننا الآن سترى بنفسك
أحيانًا نمتلك أيضًا المعجزات.
خبرة: رش ثنائي كرومات الأمونيوم على صينية ، أضف الكحول ، أشعل النار فيه.
"وشاح مقاوم للحريق"
تذكر العناصر السحرية من القصص الخيالية ( إجابات الأطفال).
طارت بساطتنا الطائرة بعيدًا
ليس لدينا التجميع الذاتي أيضًا ،
هناك منديل سوف يضيء الآن ،
لكن ، صدقوني ، لن تكون قادرة على الاحتراق.
خبرة:بلل منديلًا بمزيج من الغراء والماء (غراء سيليكات + ماء = 1: 1.5) ، وجففه قليلاً ، ثم رطب بالكحول واشعل النار فيه.
"برتقال ، ليمون ، تفاح"
والآن السحر التالي ، نحصل على آخر من عصير واحد.
خبرة:أولاً ، يتم عرض كوب به محلول ثنائي كرومات البوتاسيوم ، وهو برتقالي اللون ، للجمهور. ثم يضاف القلوي ، فيتحول "عصير البرتقال" إلى "ليمون". ثم يتم عمل العكس: من "عصير الليمون" - "برتقالة" ، يتم إضافة القليل من حامض الكبريتيك ، ثم يضاف القليل من محلول بيروكسيد الهيدروجين ويصبح "العصير" "تفاحة".
"التئام الجروح"
هناك ثلاث فقاعات على المنضدة: "اليود" (محلول FeCl 3 ) ، "كحول" (KCNS)، "الماء الحي" (ناف).
هذه متعة أخرى لك
من يمد يده لقطع؟
إنه لأمر مؤسف أن يتم قطع اليد ،
ثم يحتاج المريض للعلاج! (تمت دعوة الفتى الأشجع)
نعمل بدون ألم.
الحقيقة ستكون الكثير من الدماء.
كل عملية تتطلب التعقيم.
مساعدة ، مساعد ،
أعط الكحول.
لحظة واحدة! (يعطي الكحول- KCNS)سنشحم بالكحول بكثرة.
لا تستدير أيها المريض
أعطني مشرط ، مساعد!
("المبضع" هو عصا مغموسة في FeCl 3
)
انظر مباشرة في قطرة
الدم يتدفق وليس الماء.
ولكن الآن سوف أجفف يدي -
لا أثر للقطع!
"اليود" - محلول FeCl 3
، "الكحول" - KCNS ، "الماء الحي" - NaF.
"نحن سحرة"
والآن أنت نفسك ستصبح سحرة. سنقوم الآن بإجراء تجربة.
حليب ملون.أقترح أن تحصل على حليب أزرق. هل يحدث هذا في الطبيعة؟ لا ، لكننا سننجح ، أنت فقط لا تستطيع أن تشربه. ادمج كبريتات النحاس وكلوريد الباريوم معًا.
أصدقائي الأعزاء! لذلك انتهت معجزاتنا وتجاربنا المسلية. نحن آمل أن تكونوا مثلهم! إذا كنت تعرف الكيمياء ، فلن يكون من الصعب عليك كشف أسرار "المعجزات". كبر وتعال إلينا لدراسة هذا العلم المثير للاهتمام للغاية - الكيمياء. حتى المرة القادمة!
تجربة كيميائية للبروم مع الألومنيوم
إذا وضعت بضعة مليلتر من البروم في أنبوب اختبار مصنوع من زجاج مقاوم للحرارة وقمت بخفض قطعة من رقائق الألومنيوم فيه بعناية ، فبعد فترة (ضروري للبروم لاختراق فيلم الأكسيد) سيبدأ رد فعل عنيف. من الحرارة المنبعثة ، يذوب الألمنيوم ويتدحرج مثل كرة صغيرة من النار على سطح البروم (كثافة الألومنيوم السائل أقل من كثافة البروم) ، ويتناقص حجمه بسرعة. الأنبوب مليء ببخار البروم والدخان الأبيض ، ويتكون من أصغر بلورات بروميد الألومنيوم:
2Al + 3Вr 2 → 2AlВr 3.
من المثير للاهتمام أيضًا ملاحظة تفاعل الألومنيوم مع اليود. في وعاء خزفي ، اخلطي كمية صغيرة من مسحوق اليود مع مسحوق الألمنيوم. حتى الآن ، التفاعل غير ملحوظ: في حالة عدم وجود الماء ، فإنه يتقدم ببطء شديد. باستخدام ماصة طويلة ، قم بإسقاط بضع قطرات من الماء على الخليط ، الذي يلعب دور البادئ ، وسيستمر التفاعل بقوة - مع تكوين لهب وإطلاق بخار اليود البنفسجي.
التجارب الكيميائية على البارود: كيف ينفجر البارود!
 البارود
البارود البارود المدخن أو الأسود عبارة عن خليط من نترات البوتاسيوم (نترات البوتاسيوم - KNO 3) والكبريت (S) والفحم (C). تشتعل عند درجة حرارة حوالي 300 درجة مئوية. يمكن أن ينفجر البارود أيضًا عند الاصطدام. يحتوي على عامل مؤكسد (نترات) وعامل مختزل (الفحم). الكبريت هو أيضًا عامل اختزال ، لكن وظيفته الرئيسية هي ربط البوتاسيوم بمركب قوي. عندما يحترق البارود يحدث رد فعل:
2KNO 3 + ЗС + S → K 2 S + N 2 + 3СО 2 ،
- ونتيجة لذلك يتم إطلاق كمية كبيرة من المواد الغازية. هذا هو سبب استخدام البارود في الشؤون العسكرية: الغازات المتكونة أثناء الانفجار والتمدد من حرارة التفاعل تدفع الرصاصة خارج فوهة البندقية. يمكن التحقق من تكوين كبريتيد البوتاسيوم بسهولة عن طريق شم فوهة البندقية. تنبعث منه رائحة كبريتيد الهيدروجين - وهو أحد منتجات التحلل المائي لكبريتيد البوتاسيوم.
تجارب كيميائية مع الملح الصخري: نقش ناري
مذهل تجربة كيميائيةيمكن إجراؤه باستخدام نترات البوتاسيوم. اسمحوا لي أن أذكركم أن الملح الصخري مادة معقدة - أملاح حمض النيتريك. في هذه الحالة نحتاج نترات البوتاسيوم. صيغته الكيميائية هي KNO 3. على قطعة من الورق ، ارسم محيطًا ، رسمًا (لمزيد من التأثير ، دع الخطوط لا تتقاطع!). تحضير محلول مركز من نترات البوتاسيوم. للعلم: 20 جرام من KNO 3 مذاب في 15 مل من الماء الساخن. ثم بمساعدة فرشاة نقوم بتشبع الورق على طول الكفاف المرسوم ، مع عدم ترك فجوات أو فجوات. دع الورق يجف. أنت الآن بحاجة إلى لمس الشظية المحترقة إلى نقطة ما على المحيط. ستظهر فورًا "شرارة" تتحرك ببطء على طول محيط الرسم حتى تغلقه تمامًا. إليك ما يحدث: تتحلل نترات البوتاسيوم وفقًا للمعادلة:
2KNO 3 → 2 KNO 2 + O 2.
هنا KNO 2 + O 2 عبارة عن ملح حمض النيتروز. سوف يتفحم الأكسجين المنبعث ويحرق الورق. للحصول على تأثير أكبر ، يمكن إجراء التجربة في غرفة مظلمة.
تجربة كيميائية لإذابة الزجاج في حمض الهيدروفلوريك
 الزجاج يذوب
الزجاج يذوب في حمض الهيدروفلوريك
في الواقع ، يذوب الزجاج بسهولة. الزجاج سائل شديد اللزوجة. يمكن التحقق من حقيقة أن الزجاج يمكن أن يذوب عن طريق إجراء التفاعل الكيميائي التالي. حمض الهيدروفلوريك هو حمض يتكون عن طريق إذابة فلوريد الهيدروجين (HF) في الماء. ويسمى أيضًا حمض الهيدروفلوريك. لمزيد من الوضوح ، دعنا نأخذ بقعة رقيقة نعلق عليها وزنًا. نخفض الزجاج بوزن إلى محلول حمض الهيدروفلوريك. عندما يذوب الزجاج في الحمض ، ينخفض الوزن إلى قاع القارورة.
تجارب كيميائية مع تطور الدخان
 التفاعلات الكيميائية مع
التفاعلات الكيميائية مع انبعاث دخان
(كلوريد الأمونيوم)
لنقم بتجربة جميلة للحصول على دخان أبيض كثيف. للقيام بذلك ، نحتاج إلى تحضير خليط من البوتاس (كربونات البوتاسيوم K 2 CO 3) بمحلول الأمونيا (الأمونيا). دعونا نخلط الكواشف: البوتاس والأمونيا. أضف محلول حمض الهيدروكلوريك إلى الخليط الناتج. سيبدأ التفاعل بالفعل في اللحظة التي يقترب فيها دورق حمض الهيدروكلوريك من القارورة التي تحتوي على الأمونيا. أضف حمض الهيدروكلوريك برفق إلى محلول الأمونيا ولاحظ تكوين بخار أبيض سميك من كلوريد الأمونيوم ، والذي تكون صيغته الكيميائية NH 4 Cl. يستمر التفاعل الكيميائي بين الأمونيا وحمض الهيدروكلوريك على النحو التالي:
حمض الهيدروكلوريك + NH 3 → NH 4 Cl
التجارب الكيميائية: توهج الحلول
 تفاعل توهج المحلول
تفاعل توهج المحلول كما هو مذكور أعلاه ، فإن توهج المحاليل هو علامة على تفاعل كيميائي. لنقم بتجربة مذهلة أخرى ، حيث يتوهج حلنا. للتفاعل ، نحتاج إلى محلول من luminol ، ومحلول بيروكسيد الهيدروجين H 2 O 2 وبلورات من ملح الدم الأحمر K 3. لومينول- مادة عضوية معقدة ، صيغتها C 8 H 7 N 3 O 2. يذوب Luminol جيدًا في بعض المذيبات العضوية ، بينما لا يذوب في الماء. يحدث التوهج عندما يتفاعل luminol مع بعض المؤكسدات في بيئة قلوية.
لذا ، لنبدأ: أضف محلول بيروكسيد الهيدروجين إلى لومينول ، ثم أضف حفنة من بلورات ملح الدم الأحمر إلى المحلول الناتج. حاول إجراء التجربة في غرفة مظلمة لمزيد من التأثير! بمجرد أن تلمس بلورات ملح الدم الأحمر المحلول ، سيكون هناك توهج أزرق بارد يمكن ملاحظته على الفور ، مما يشير إلى مسار التفاعل. يسمى التوهج الناتج عن تفاعل كيميائي تلألؤ كيميائي
اخر تجربة كيميائيةمع المحاليل المضيئة:
نحتاج إلى: الهيدروكينون (المستخدم سابقًا في معدات التصوير) ، كربونات البوتاسيوم K 2 CO 3 (المعروف أيضًا باسم "البوتاس") ، محلول صيدلاني من الفورمالين (الفورمالديهايد) وبيروكسيد الهيدروجين. قم بإذابة 1 جم من الهيدروكينون و 5 جم من كربونات البوتاسيوم K 2 CO 3 في 40 مل من الفورمالين الصيدلاني (محلول الفورمالديهايد المائي). انقل خليط التفاعل هذا إلى دورق كبير أو زجاجة بسعة لتر واحد على الأقل. في وعاء صغير ، تحضير 15 مل من محلول بيروكسيد الهيدروجين المركز. يمكنك استخدام أقراص hydroperite - مزيج من بيروكسيد الهيدروجين مع اليوريا (اليوريا لن تتداخل مع التجربة). لمزيد من التأثير ، ادخل غرفة مظلمة ، عندما تعتاد عيناك على الظلام ، صفي محلول بيروكسيد الهيدروجين في وعاء كبير من الهيدروكينون. سيبدأ الخليط في تكوين رغوة (وهذا هو السبب في أنك تحتاج إلى أخذ وعاء كبير) وسيظهر توهج برتقالي مميز!
التفاعلات الكيميائية التي يظهر فيها الوهج لا تحدث فقط أثناء الأكسدة. يحدث توهج أحيانًا أثناء التبلور. أسهل طريقة لرصده هو ملح الطعام. قم بإذابة ملح الطعام في الماء ، وتناول كمية كافية من الملح حتى تبقى البلورات غير المذابة في قاع الكوب. صب المحلول المشبع الناتج في كوب آخر وأضف حمض الهيدروكلوريك المركز إلى هذا المحلول بالتنقيط. سيبدأ الملح في التبلور وتنزلق الشرر في المحلول. الأجمل إذا كانت التجربة تدور في الظلام!

تجارب كيميائية على الكروم ومركباته
الكروم متعدد الألوان! ... يمكن أن يتغير لون أملاح الكروم بسهولة من البنفسجي إلى الأخضر والعكس صحيح. دعونا نجري التفاعل: دعونا نذيب عدة بلورات بنفسجية من كلوريد الكروم CrCl 3 6H 2 O في الماء ، وعندما يغلي ، يتحول المحلول البنفسجي لهذا الملح إلى اللون الأخضر. ينتج عن تبخير المحلول الأخضر مسحوق أخضر من نفس تركيبة الملح الأصلي. وإذا قمت بتشبع محلول أخضر من كلوريد الكروم المبرد إلى 0 درجة مئوية مع كلوريد الهيدروجين (HCl) ، سيتحول لونه إلى اللون الأرجواني مرة أخرى. كيف نفسر الظاهرة المرصودة؟ هذا مثال نادر على التماثل في الكيمياء غير العضوية - وجود مواد لها نفس التركيب ، لكن لها بنية وخصائص مختلفة. في ملح البنفسج ، ترتبط ذرة الكروم بستة جزيئات ماء ، وذرات الكلور عبارة عن مضاد: Cl 3 ، وفي كلوريد الكروم الأخضر يغيرون أماكنهم: Cl 2H 2 O. في الوسط الحمضي ، يعتبر ثنائي كرومات مؤكسد قوي. منتجات الاختزال الخاصة بهم هي أيونات Cr3 +:
К 2 Cr 2 О 7 + 4H 2 SO 4 + 3K 2 SO 3 → Cr 2 (SO 4) 3 + 4K 2 SO 4 + 4H 2 O.
 كرومات البوتاسيوم (أصفر)
كرومات البوتاسيوم (أصفر) ثنائي كرومات - (أحمر)
عند درجات الحرارة المنخفضة ، يمكن عزل بلورات البنفسج من كرومات البوتاسيوم الشب KCr (SO 4) 2 12H 2 O من المحلول الناتج ، ويسمى المحلول الأحمر الداكن الذي يتم الحصول عليه عن طريق إضافة حمض الكبريتيك المركز إلى محلول مائي مشبع من ثنائي كرومات البوتاسيوم بالكرومبيك. في المختبرات ، يتم استخدامه لغسل وإزالة الشحوم من الأواني الزجاجية الكيميائية. يتم شطف الأطباق بعناية باستخدام معول الكروم ، والذي لا يُسكب في الحوض ، ولكن يُعاد استخدامه عدة مرات. في النهاية ، يتحول الخليط إلى اللون الأخضر - كل الكروم الموجود في هذا المحلول قد انتقل بالفعل إلى شكل Cr 3+. عامل مؤكسد قوي بشكل خاص هو أكسيد الكروم (VI) CrO 3. بمساعدتها ، يمكنك إضاءة مصباح كحول بدون أعواد ثقاب: ما عليك سوى لمس الفتيل المبلل بالكحول بعصا بعدة بلورات من هذه المادة. عندما يتحلل CrO 3 ، يمكن الحصول على مسحوق بني غامق من أكسيد الكروم (IV) CrO 2. وهي مغنطيسية مغناطيسية وتستخدم في بعض أنواع أشرطة الكاسيت الصوتية. يحتوي جسم الشخص البالغ على حوالي 6 ملغ من الكروم فقط. العديد من مركبات هذا العنصر (خاصة الكرومات وثنائي كرومات) سامة ، وبعضها مسرطنة ، أي يمكن أن يسبب السرطان.
التجارب الكيميائية: الخواص المختزلة للحديد

كلوريد الحديد الثالث
يشير هذا النوع من التفاعل الكيميائي إلى تفاعلات الأكسدة والاختزال... لإجراء التفاعل ، نحتاج إلى محاليل مائية مخففة (5٪) من كلوريد الحديد (III) FeCl 3 ونفس محلول يوديد البوتاسيوم KI. لذلك ، يتم سكب محلول من كلوريد الحديد (III) في قارورة واحدة. ثم أضف بضع قطرات من محلول يوديد البوتاسيوم إليها. نلاحظ تغييرا في لون الحل. سيتحول السائل إلى اللون البني المحمر. ستحدث التفاعلات الكيميائية التالية في المحلول:
2FeCl 3 + 2KI → 2FeCl 2 + 2KCl + I 2
KI + I 2 → K.
 كلوريد الحديد الثاني
كلوريد الحديد الثاني تجربة كيميائية أخرى بمركبات الحديد. من أجل ذلك ، نحتاج إلى محاليل مائية مخففة (10-15٪) من كبريتات الحديد (II) FeSO 4 وثيوسيانات الأمونيوم NH 4 NCS ، ماء البروم Br 2. لنبدأ. صب محلول كبريتات الحديد (II) في دورق واحد. أضف 3-5 قطرات من محلول ثيوسيانات الأمونيوم هناك. لاحظ أنه لا توجد علامات على حدوث تفاعلات كيميائية. بالطبع ، كاتيونات الحديد (II) لا تشكل معقدات ملونة مع أيونات الثيوسيانات. الآن أضف ماء البروم إلى هذه القارورة. والآن أيونات الحديد "تخلت عن نفسها" وصبغت المحلول باللون الأحمر الدموي. هذه هي الطريقة التي يتفاعل بها أيون الحديد (III) التكافؤ مع أيونات الثيوسيانات. هذا ما حدث في القارورة:
Fe (H 2 O) 6] 3+ + n NCS– (n - 3) - + n H 2 O
تجربة كيميائية على تجفيف السكر بحمض الكبريتيك
 جفاف السكر
جفاف السكر حامض الكبريتيك
يعمل حمض الكبريتيك المركز على تجفيف السكر. السكر مادة عضوية معقدة ، صيغتها C 12 H 22 O 11. هذا هو كيف ستسير الامور. يوضع السكر البودرة في كأس زجاجي طويل ، مبلل قليلاً بالماء. ثم يضاف القليل من حمض الكبريتيك المركز إلى السكر الرطب. امزج بلطف وبسرعة بقضيب زجاجي. تُترك العصا في منتصف الزجاج مع الخليط. بعد دقيقة إلى دقيقتين ، يبدأ السكر في التحول إلى اللون الأسود والانتفاخ والارتفاع على شكل كتلة سوداء ضخمة وفضفاضة ، ويأخذ معها قضيبًا زجاجيًا. يصبح المزيج في الكوب ساخنًا جدًا ويدخن قليلاً. في هذا التفاعل الكيميائي ، لا يزيل حمض الكبريتيك الماء من السكر فحسب ، بل يحوله أيضًا جزئيًا إلى فحم.
C 12 H 22 O 11 + 2H 2 SO 4 (conc.) → 11C + CO 2 + 13H 2 O + 2SO 2
يتم امتصاص الماء المنطلق أثناء مثل هذا التفاعل الكيميائي بشكل أساسي بواسطة حامض الكبريتيك (يمتص حمض الكبريتيك الماء "بجشع") مع تكوين الهيدرات ، وبالتالي الإطلاق القوي للحرارة. وثاني أكسيد الكربون CO 2 ، الذي يتم الحصول عليه أثناء أكسدة السكر ، وثاني أكسيد الكبريت SO 2 يرفعان خليط الفحم إلى أعلى.
تجربة كيميائية مع اختفاء ملعقة الألمنيوم
لنقم بتفاعل كيميائي مضحك آخر: لهذا نحتاج إلى ملعقة من الألومنيوم ونترات الزئبق (Hg (NO 3) 2). لذلك ، خذ ملعقة ، ونظفها بورق صنفرة ناعم الحبيبات ، ثم أزل الشحوم بالأسيتون. اغمس ملعقة في محلول نترات الزئبق (Hg (NO 3) 2) لبضع ثوان. (تذكر أن مركبات الزئبق سامة!). بمجرد أن يتحول لون سطح ملعقة الألومنيوم في محلول من الزئبق إلى اللون الرمادي ، يجب إزالة الملعقة وغسلها بالماء المغلي وتجفيفها (تبلل ، ولكن لا تمسح). بعد بضع ثوانٍ ، ستتحول الملعقة المعدنية إلى رقائق بيضاء رقيقة ، وسرعان ما يتبقى منها كومة رمادية من الرماد. إليكم ما حدث:
Al + 3 Hg (NO 3) 2 → 3 Hg + 2 Al (NO 3) 3.
في المحلول ، في بداية التفاعل ، تظهر طبقة رقيقة من ملغم الألومنيوم (سبيكة من الألومنيوم والزئبق) على سطح الملعقة. يتحول الملغم بعد ذلك إلى رقائق بيضاء رقيقة من هيدروكسيد الألومنيوم (Al (OH) 3). يتم تجديد المعدن المستهلك في التفاعل بأجزاء جديدة من الألومنيوم مذابة في الزئبق. وأخيرًا ، بدلاً من الملعقة اللامعة ، يبقى مسحوق Al (OH) 3 الأبيض وقطرات صغيرة من الزئبق على الورق. إذا تم غمر ملعقة الألومنيوم فورًا في الماء المقطر بعد محلول نترات الزئبق (Hg (NO 3) 2) ، فستظهر فقاعات غاز ورقائق بيضاء على سطحها (سيتطور الهيدروجين وهيدروكسيد الألومنيوم).
يزيد هذا الدليل الاهتمام بالموضوع ويطور الأنشطة المعرفية والتفكيرية والبحثية. يقوم الطلاب بتحليل المواد ومقارنتها ودراستها وتعميمها واكتساب معلومات جديدة ومهارات عملية. يمكن للطلاب إجراء بعض التجارب بأنفسهم في المنزل ، ولكن معظمها في فصل الكيمياء بتوجيه من المعلم.
تحميل:
معاينة:
smt. نوفوميكايلوفسكي
الكيان البلدي
منطقة توابسي
"تفاعلات كيميائية من حولنا"
معلم:
كوزلينكو
أليفتينا فيكتوروفنا
2015 ز.
« بركان "على الطاولة.يُسكب ثنائي كرومات الأمونيوم الممزوج بالمغنيسيوم المعدني في البوتقة (في الوسط ، يتم ترطيب الكومة بالكحول). أشعل "البركان" بشعلة مشتعلة. يكون التفاعل طاردًا للحرارة ، ويستمر بعنف ، جنبًا إلى جنب مع النيتروجين ، تتطاير الجزيئات الساخنة من أكسيد الكروم (III) وتتطاير
حرق المغنيسيوم. إذا أطفأت الضوء ، فسيكون لديك انطباع بثوران بركان ، من فوهة البركان التي تتدفق منها الكتل الساخنة:
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + 4H 2 O + N 2 ؛ 2Mg + O 2 = 2MgO.
"ستار راين".يُسكب على ورقة نظيفة مع التحريك جيدًا ، ثلاث ملاعق كبيرة من برمنجنات البوتاسيوم ومسحوق الفحم ومسحوق الحديد المخفف. يُسكب الخليط الناتج في بوتقة حديدية ، يتم تثبيتها في حلقة الحامل الثلاثي ويتم تسخينها بواسطة شعلة مصباح كحول. يبدأ التفاعل ويتم التخلص من الخليط
على شكل شرارات كثيرة ، مما يعطي الانطباع بـ "مطر من نار".
ألعاب نارية في منتصف السائل... يُسكب 5 مل من حمض الكبريتيك المركز في الأسطوانة ويُسكب 5 مل من الكحول الإيثيلي بعناية على طول جدار الأسطوانة ، ثم يتم إلقاء بعض بلورات برمنجنات البوتاسيوم. تظهر شرارات على الحدود بين السائلين مصحوبة بفرقعة. يشتعل الكحول عند ظهور الأكسجين ، والذي يتكون من تفاعل برمنجنات البوتاسيوم مع حمض الكبريتيك.
"حريق الأخضر" ... يشكل حمض البوريك مع كحول الإيثيل إستر:
H 3 VO 3 + 3C 2 H 5 OH = B (OS 2 H 5) + 3H 2 O
يُسكب 1 غرام من حمض البوريك في كوب خزفي ، ويضاف 10 مل من الكحول و 1 مل من حامض الكبريتيك. يقلب الخليط بقضيب زجاجي ويشعل. بخار الأثير يحترق بلهب أخضر.
الماء يشعل الورق... في وعاء خزفي ، اخلطي بيروكسيد الصوديوم مع قطع صغيرة من ورق الترشيح. تُقطر بضع قطرات من الماء على الخليط المُجهز. الورق قابل للاشتعال.
Na 2 O 2 + 2H 2 O = H 2 O 2 + 2NaOH
2H 2 O 2 = 2H 2 O + O 2 |
لهب متعدد الألوان.يمكن إظهار ألوان اللهب المختلفة عن طريق حرق الكلوريدات في الكحول. للقيام بذلك ، خذ أكواب خزفية نظيفة مع 2-3 مل من الكحول. يضاف 0.2-0.5 جم من الكلوريدات المطحونة ناعماً إلى الكحول. يتم إشعال النار في الخليط. في كل كوب ، يكون لون اللهب هو سمة الكاتيون الموجود في الملح: الليثيوم - التوت ، والصوديوم - الأصفر ، والبوتاسيوم - البنفسجي ، والروبيديوم والسيزيوم - البنفسجي الوردي ، والكالسيوم - القرميد الأحمر ، والباريوم - الأخضر المصفر ، السترونتيوم - توت العليق ، إلخ.
العصي السحرية.املأ ثلاثة أكواب بمحلول عباد الشمس وبرتقال الميثيل والفينول فثالين بحوالي 3/4 من حجمها.
في أكواب أخرى ، قم بإعداد محاليل حمض الهيدروكلوريك وهيدروكسيد الصوديوم. يتم جمع محلول هيدروكسيد الصوديوم بواسطة أنبوب زجاجي. قلّب باستخدام أنبوب السائل هذا في جميع الكؤوس ، مع سكب كمية صغيرة من المحلول في كل مرة بشكل غير محسوس. سيتغير لون السائل في الأكواب. ثم يجمعون الحمض في الأنبوب الثاني بهذه الطريقة.ونخلط السوائل معها في أكواب. سيتغير لون المؤشرات بشكل كبير مرة أخرى.
عصا سحرية.للتجربة ، يتم وضع عصيدة معدة مسبقًا من برمنجنات البوتاسيوم وحمض الكبريتيك المركز في أكواب خزفية. يتم غمر قضيب الزجاج في خليط مؤكسد طازج. قم بإحضار العصا بسرعة إلى الفتيل المبلل لمصباح كحول أو صوف قطني مغمور بالكحول ، حيث يشتعل الفتيل. (لا تقم بإضافة عصا مبللة بالكحول إلى العصيدة).
2KMnO 4 + H 2 SO 4 = Mn 2 O 7 + K 2 SO 4 + H 2 O
6Мп 2 О 7 + 5С 2 Н 5 ОН + 12H 2 SO 4 = l2MnSO 4 + 10СО 2 + 27Н 2 О
يحدث التفاعل مع إطلاق كمية كبيرة من الحرارة ، يشتعل الكحول.
سائل إشعال ذاتي.يتم وضع 0.5 جرام من بلورات برمنجنات البوتاسيوم المطحونة قليلاً في ملاط في كوب خزفي ، ثم يتم وضع 3-4 قطرات من الجلسرين من ماصة. بعد فترة يشتعل الجلسرين:
14KMnO 4 + 3C 3 H 6 (OH) 3 = 14MnO 2 + 9CO 2 + 5H 2 O + 14KON
احتراق مواد مختلفةفي البلورات المنصهرة.
ثلاثة 1/3 أنابيب مملوءة ببلورات بيضاء من نترات البوتاسيوم. يتم تثبيت جميع أنابيب الاختبار الثلاثة عموديًا في رف ويتم تسخينها في نفس الوقت بثلاثة مصابيح روحية. عندما تذوب البلوراتيتم غمر قطعة من الفحم الساخن في أنبوب الاختبار الأول ، وقطعة من الكبريت الساخن في الأنبوب الثاني ، وقليل من الفوسفور الأحمر في الأنبوب الثالث. في أنبوب الاختبار الأول ، يحترق الفحم ، "يقفز" في نفس الوقت. في أنبوب الاختبار الثاني ، تحترق قطعة من الكبريت بلهب ساطع. في أنبوب الاختبار الثالث ، يحترق الفوسفور الأحمر ، مما يؤدي إلى إطلاق كمية من الحرارة بحيث يذوب أنبوب الاختبار.
الماء عامل مساعد.على طبق زجاجي ، امزج بلطف
4 جرام من مسحوق اليود و 2 جرام من غبار الزنك. لا يحدث رد فعل. يتم تقطير بضع قطرات من الماء على الخليط. يبدأ التفاعل الطارد للحرارة بإطلاق بخار اليود البنفسجي الذي يتفاعل مع الزنك. تجرى التجربة تحت تأثير الجر.
الاشتعال الذاتي للبارافين.املأ ثلث الأنبوب بقطع من البارافين وسخنه حتى درجة الغليان. صب البارافين المغلي من أنبوب اختبار ، من ارتفاع حوالي 20 سم ، في تيار رفيع. البارافين يلهب ويحترق بلهب مشرق. (في أنبوب الاختبار ، لا يمكن أن يشتعل البارافين ، لأنه لا يوجد دوران للهواء. وعندما يصب البارافين في تيار رقيق ، يصبح الوصول إلى الهواء أسهل. وبما أن درجة حرارة البارافين المنصهر أعلى من درجة حرارة الاشتعال ، فإنه يشتعل .)
مؤسسة تعليمية بلدية مستقلة
الثانوية العامة رقم 35
smt. نوفوميكايلوفسكي
الكيان البلدي
منطقة توابسي
تجارب مسلية حول الموضوع
"الكيمياء في بيتنا"
معلم:
كوزلينكو
أليفتينا فيكتوروفنا
عام 2015
دخان بدون نار. تُسكب بضع قطرات من حمض الهيدروكلوريك المركز في أسطوانة واحدة مغسولة جيدًا ، ويُسكب محلول الأمونيا في الأخرى. يتم إغلاق كلتا الأسطوانتين بأغطية ووضعهما على مسافة ما من بعضهما البعض. قبل التجربة تبين أن الاسطوانات. أثناء العرض ، تنقلب أسطوانة حمض الهيدروكلوريك (على الجدران) رأسًا على عقب وتوضع على غطاء أسطوانة الأمونيا. يتم إزالة الغطاء: يتشكل دخان أبيض.
سكين "ذهبي". أضف إلى 200 مل من محلول مشبع من كبريتات النحاس 1 مل من حامض الكبريتيك. خذ سكينًا ، مُنظف بورق الصنفرة. يقومون بخفض السكين لبضع ثوان في محلول من كبريتات النحاس ، ثم يخرجونه ، ويشطفونه ، ثم يجفونه على الفور بمنشفة. يصبح السكين "ذهبي". كانت مغطاة بطبقة لامعة من النحاس.
زجاج تجميد.تُسكب نترات الأمونيوم في كوب من الماء وتوضع على الخشب الرقائقي الرطب الذي يتجمد في الزجاج.
حلول ملونة... قبل التجربة ، تم تجفيف هيدرات بلورية من أملاح النحاس والنيكل والكوبالت. بعد إضافة الماء إليها ، يتم تشكيل المحاليل الملونة. مسحوق ملح النحاس الأبيض اللامائي يشكل محلول أزرق ، مسحوق ملح أخضر نيكل أخضر ، مسحوق ملح أزرق 4 الكوبالت أحمر.
دم بلا جرح. لإجراء التجربة ، استخدم 100 مل من محلول 3٪ من كلوريد الحديديك FeCI 3 في 100 حمأة من 3 ٪ محلول ثيوسيانات البوتاسيوم KCNS. يتم استخدام سيف بلاستيكي للأطفال لإثبات التجربة. اتصل بشخص ما من الجمهور على المسرح. يتم غسل النخيل بقطعة قطن بمحلول FeCI 3 والسيف مبلل بمحلول عديم اللون من KCNS. بعد ذلك ، يُمسك السيف في راحة اليد: يتدفق "الدم" بغزارة على الورق:
FeCl 3 + 3KCNS = Fe (CNS) 3 + 3KCl
يتم غسل "الدم" من راحة اليد بقطعة قطن مبللة بمحلول فلوريد الصوديوم. يظهرون للجمهور أنه لا يوجد جرح وأن راحة اليد نظيفة تمامًا.
لون فوري "التصوير الفوتوغرافي".تتفاعل أملاح الدم الصفراء والحمراء مع أملاح المعادن الثقيلة ، وتعطي ألوانًا مختلفة من نواتج التفاعل: ملح الدم الأصفر مع كبريتات الحديد (III) يعطي لونًا أزرق ، مع أملاح النحاس (II) - بني غامق ، مع أملاح البزموت - أصفر ، مع أملاح الحديد (II) - أخضر. باستخدام الحلول المذكورة أعلاه للأملاح على ورق أبيض ، يتم عمل رسم وتجفيفه. نظرًا لأن الحلول عديمة اللون ، يظل الورق غير ملون. لإظهار مثل هذه الرسومات على الورق ، يتم إجراؤها باستخدام قطعة مبللة مبللة بمحلول من ملح الدم الأصفر.
تحويل السائل إلى هلام.صب 100 غرام من محلول سيليكات الصوديوم في دورق وأضف 5 مل من محلول حمض الهيدروكلوريك 24٪. قلّب خليط هذه المحاليل بقضيب زجاجي وأمسك القضيب في المحلول عموديًا ، وبعد 1-2 دقيقة لا يسقط القضيب في المحلول ، لأن السائل يتكاثف بحيث لا ينسكب من الزجاج.
فراغ كيميائي في زجاجة. املأ الزجاجة بثاني أكسيد الكربون. صب القليل من المحلول المركز من هيدروكسيد البوتاسيوم فيه وأغلق فتحة الزجاجة ببيضة صلبة مقشرة ، سطحها ملطخ بطبقة رقيقة من الفازلين. تبدأ البيضة تدريجيًا في السحب إلى الزجاجة وتسقط عليها بصوت حادقاعه.
(فراغ يتكون في الزجاجة نتيجة التفاعل:
CO 2 + 2KON = K 2 CO 3 + H 2 O.
ضغط الهواء الخارجي يدفع البيضة.)
منديل مقاوم للحريق.يُشرب المنديل بمحلول سيليكات الصوديوم ، ويُجفف ويُطوى. لإثبات عدم قابليتها للاحتراق ، يتم ترطيبها بالكحول وإشعال النار فيها. يجب إمساك المنديل بشكل مسطح باستخدام ملقط بوتقة. يحترق الكحول وتبقى قطعة القماش المشبعة بسيليكات الصوديوم سليمة.
السكر يحترق.خذ قطعة من السكر المكرر بملقط وحاول إشعال النار فيها - السكر لا يشتعل. إذا تم رش هذه القطعة برماد سيجارة ، ثم أضرمت فيها النيران بمباراة ، فإن السكر يشتعل بلهب أزرق لامع ويحترق بسرعة.
(يحتوي الرماد على مركبات الليثيوم التي تعمل كمحفز.)
الفحم من السكر. قم بوزن 30 جرام من السكر البودرة وانقله إلى دورق. أضف ~ 12 مل من حمض الكبريتيك المركز إلى السكر البودرة. قلّب السكر والحمض بقضيب زجاجي في كتلة طرية. بعد فترة ، يتحول المزيج إلى اللون الأسود ويسخن ، وسرعان ما تبدأ كتلة الفحم المسامية في الخروج من الزجاج.
مؤسسة تعليمية بلدية مستقلة
الثانوية العامة رقم 35
smt. نوفوميكايلوفسكي
الكيان البلدي
منطقة توابسي
تجارب مسلية حول الموضوع
"كيمياء في الطبيعة"
معلم:
كوزلينكو
أليفتينا فيكتوروفنا
عام 2015
استخراج "الذهب".يذوب أسيتات الرصاص في دورق واحد بالماء الساخن ويذوب يوديد البوتاسيوم في الآخر. يُسكب كلا المحلين في دورق كبير ، ويُترك ليبرد ويُظهر رقائق ذهبية جميلة تطفو في المحلول.
Pb (CH 3 COO) 2 + 2KI = PbI 2 + 2CH3COOK
المعدنية "الحرباء".يُسكب 3 مل من محلول مشبع من برمنجنات البوتاسيوم و 1 مل من محلول 10٪ من هيدروكسيد البوتاسيوم في أنبوب اختبار.
إلى الخليط الناتج ، أثناء الرج ، أضف 10-15 قطرة من محلول كبريتيت الصوديوم حتى يظهر لون أخضر غامق. مع التحريك ، يتحول لون المحلول إلى اللون الأزرق ، ثم الأرجواني ثم القرمزي في النهاية.
يرجع ظهور اللون الأخضر الداكن إلى تكوين منغنات البوتاسيوم
K 2 MnO 4:
2KMnO 4 + 2KON + Na 2 SO 3 = 2K 2 MnO 4 + Na 2 SO 4 + H 2 O.
يفسر التغير في اللون الأخضر الداكن للمحلول تحلل منجنات البوتاسيوم تحت تأثير الأكسجين الجوي:
4K 2 MnO 4 + O 2 + 2H 2 O = 4KMpO 4 + 4KON.
تحويل الفسفور الأحمر إلى الأبيض.يُغمس قضيب زجاجي في أنبوب اختبار جاف ويوضع فوسفور أحمر في حجم نصف حبة بازلاء. يتم تسخين قاع الأنبوب بقوة. يظهر الدخان الأبيض أولاً. عند مزيد من التسخين ، تظهر قطرات صفراء من الفوسفور الأبيض على الجدران الداخلية الباردة لأنبوب الاختبار. يتم ترسيبه أيضًا على قضيب زجاجي. بعد إيقاف تسخين أنبوب الاختبار ، قم بإزالة قضيب الزجاج. يشتعل الفوسفور الأبيض عليه. تتم إزالة الفوسفور الأبيض من الجدران الداخلية لأنبوب الاختبار بنهاية قضيب زجاجي. يحدث وميض ثان في الهواء.
فقط المعلم هو من يقوم بالتجربة.
ثعابين فرعون. للتجربة ، يتم تحضير ملح - الزئبق (II) ثيوسيانات عن طريق خلط محلول مركّز من نترات الزئبق (II) مع محلول 10٪ من ثيوسيانات البوتاسيوم. يتم ترشيح الراسب وغسله بالماء وتصنع العصي بسمك 3-5 مم وطول 4 سم وتجفف العصي على زجاج في درجة حرارة الغرفة. أثناء المظاهرة ، توضع العصي على منضدة العرض وتُضرم فيها النيران. نتيجة لتحلل الزئبق (II) thiocyanate ، يتم إطلاق المنتجات التي تأخذ شكل ثعبان متموج. حجمه أكبر بعدة مرات من الحجم الأصلي للملح:
Hg (NO 3) 2 + 2KCNS = Нg (CNS) 2 + 2KNO 3
2Hg (CNS | 2 = 2HgS + CS 2 + C 3 N 4.
"ثعبان" رمادي غامق.يُسكب الرمل في مُبلور أو على لوح زجاجي مع مخروط ويُشرب بالكحول. يتم عمل ثقب في وسط المخروط ويوضع هناك مزيج من 2 جم من صودا الخبز و 13 جم من السكر البودرة. تم إشعال النار في الكحول. يتحول Caxap إلى كراميل ويتفكك الصودا لإطلاق أول أكسيد الكربون (IV). "ثعبان" كثيف رمادي غامق يزحف من الرمال. كلما طال احتراق الكحول ، زاد طول الثعبان.
"طحالب كيميائية». يُسكب محلول من غراء السيليكات (سيليكات الصوديوم) المخفف بكمية متساوية من الماء في كوب. يتم إلقاء بلورات من كلوريد الكالسيوم والمنغنيز (II) والكوبالت (II) والنيكل (II) ومعادن أخرى في قاع الزجاج. بعد فترة ، تبدأ بلورات السيليكات المماثلة القابلة للذوبان بشكل ضئيل ، والتي تشبه الطحالب ، في النمو في الزجاج.
حرق الثلج. جنبا إلى جنب مع الثلج ، يتم وضع 1-2 قطعة من كربيد الكالسيوم في الجرة. بعد ذلك ، يتم إحضار شظية محترقة إلى البنك. يتصاعد الثلج ويحترق بلهب مدخن. يحدث التفاعل بين كربيد الكالسيوم والماء:
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
الغازات المتصاعدة - حروق الأسيتيلين:
2C 2 H 2 + 5O 2 = 4CO 2 + 2H 2 O.
"بوران" في كوب.يُسكب 5 جم من حمض البنزويك في دورق سعة 500 مل ويوضع غصين من الصنوبر. غطي الزجاج بكوب من البورسلين بالماء البارد وقم بتسخينه فوق مصباح روح. يذوب الحمض أولاً ، ثم يتحول إلى بخار ، ويمتلئ الزجاج "بالثلج" الأبيض الذي يغطي الغصين.
الثانوية العامة رقم 35
ص. Novomikhaylovsky
الكيان البلدي
منطقة توابسي
تجارب مسلية حول الموضوع
"الكيمياء في الزراعة"
معلم:
كوزلينكو
أليفتينا فيكتوروفنا
عام 2015
طرق مختلفة للحصول على "الحليب".للتجربة ، تحضير المحاليل: كلوريد الصوديوم ونترات الفضة ؛ كلوريد الباريوم وكبريتات الصوديوم. كلوريد الكالسيوم وكربونات الصوديوم. صب هذه المحاليل في أكواب منفصلة. كل منهم يشكل "حليب" - أملاح بيضاء غير قابلة للذوبان:
NaCI + AgNO 3 = AgCI ↓ + NaNO 3 ؛
Na 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2NaCI ؛
Na 2 CO 3 + CaCI 2 = CaCO 3 + 2NaCI.
تحول "الحليب إلى ماء".يضاف فائض حمض الهيدروكلوريك إلى الراسب الأبيض الناتج عن دمج محاليل كلوريد الكالسيوم وكربونات الصوديوم. السائل يغلي ويصبح عديم اللون و
شفاف:
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl ؛
CaCOz ↓ + 2HCI = CaCI 2 + H 2 O + CO 2.
بيضة أصلية... تُغمس بيضة دجاج في وعاء زجاجي بمحلول حمض الهيدروكلوريك المخفف. بعد 2-3 دقائق ، تُغطى البيضة بفقاعات غازية وتطفو على سطح السائل. تنفجر فقاعات الغاز ، وتغرق البيضة في القاع مرة أخرى. لذلك ، عند الغوص والارتفاع ، تتحرك البيضة حتى تذوب القشرة.
مؤسسة تعليمية بلدية
الثانوية العامة رقم 35
ص. Novomikhaylovsky
البلدية
منطقة توابسي
نشاط خارج الصف
"أسئلة مثيرة للاهتمام حول الكيمياء"
معلم:
كوزلينكو
أليفتينا فيكتوروفنا
2015 ز.
اختبار.
1. قم بتسمية العناصر العشرة الأكثر شيوعًا في القشرة الأرضية.
2. ما العنصر الكيميائي الذي تم اكتشافه في وقت مبكر على الشمس أكثر من الأرض؟
3. ما هو المعدن النادر الموجود في بعض الأحجار الكريمة؟
4. ما هو هواء الهليوم؟
5. ما المعادن والسبائك التي تذوب في الماء الساخن؟
6. ما هي المعادن المقاومة للصهر هل تعرف؟
7. ما هو الماء الثقيل؟
8. قم بتسمية العناصر التي يتكون منها جسم الإنسان.
9. ما هي أثقل الغازات والسوائل والمواد الصلبة؟
10. كم عدد العناصر المستخدمة في صناعة السيارة؟
11. ما هي العناصر الكيميائية التي تدخل النبات من الهواء والماء والتربة؟
12. ما أملاح أحماض الكبريتيك والهيدروكلوريك المستخدمة لحماية النباتات من الآفات والأمراض؟
13. ما هو نوع المعدن المنصهر الذي يمكن استخدامه لتجميد الماء /؟
14. هل ينفع الإنسان شرب الماء النظيف؟
15. من كان أول من حدد التركيب الكيميائي الكمي للماء بطرق التوليف والتحليل؟
16 . ما هو الغاز الصلب عند درجة الحرارة - 2>252 تتحد درجة مئوية مع انفجار مع الهيدروجين السائل؟
17. ما هو عنصر أساس العالم المعدني بأكمله لكوكب نانكي؟
18. ما مركب الكلور مع الزئبق هو سم قوي؟
19. ما هي أسماء العناصر المرتبطة بالعمليات المشعة؟
الإجابات:
1. العناصر التالية هي الأكثر انتشارًا في القشرة الأرضية: الأكسجين ، السيليكون ، الألمنيوم ، الحديد ، الكالسيوم ، الصوديوم ، المغنيسيوم ، البوتاسيوم ، الهيدروجين ، التيتانيوم. تحتل هذه العناصر حوالي 96.4٪ من كتلة القشرة الأرضية. بالنسبة لجميع العناصر الأخرى ، يتبقى 3.5٪ فقط من كتلة القشرة الأرضية.
2. تم اكتشاف الهيليوم لأول مرة على الشمس ، وبعد ربع قرن فقط تم العثور عليه على الأرض.
3. يوجد معدن البريليوم في الطبيعة كجزء لا يتجزأ من الأحجار الكريمة (البريل ، الزبرجد ، الإسكندريت ، إلخ).
4. هذا هو اسم الهواء الصناعي الذي يحتوي على حوالي 20٪ أكسجين و 80٪ هيليوم.
5. تذوب المعادن التالية في الماء الساخن: السيزيوم (+28.5 درجة مئوية) ، الغاليوم (+ 29.75 درجة مئوية) ، الروبيديوم (+ 39 درجة مئوية) ، البوتاسيوم (+63 درجة مئوية). سبائك الخشب (50٪ ثنائية ، 25٪ Pb ، 12.5٪ Sn ، 12.5٪ Cd) تذوب عند درجة حرارة +60.5درجة مئوية.
6. أكثر المعادن مقاومة للصهر مثل: التنجستن (3370 درجة مئوية) ، الرينيوم (3160 درجة مئوية) ، التنتالوم (3000 درجة مئوية) ، الأوزميوم (2700 درجة مئوية) ، الموليبدينوم (2620 درجة مئوية) ، النيوبيوم (2415 درجة مئوية) .
7. الماء الثقيل هو مركب من نظير الهيدروجين الديوتيريوم مع الأكسجين د 2 ج: توجد كمية قليلة من الماء الثقيل في الماء العادي (جزء واحد بالوزن إلى 5000 جزء بالوزن).
8. يحتوي جسم الإنسان على أكثر من 20 عنصرًا: الأكسجين (65.04٪) ، الكربون (18.25٪) ، الهيدروجين (10.05٪) ، النيتروجين (2.65٪) ، الكالسيوم (1.4٪) ، الفوسفور (0.84٪) ، البوتاسيوم (0.27٪). ٪) ، كلور (0.21٪) ، كبريت (0.21٪) و
الدكتور.
9. أثقل الغاز المأخوذ في ظل الظروف العادية هو سداسي فلوريد التنغستن WF 6 ، أثقل سائل هو الزئبق ، وأثقل مادة صلبة هو معدن الأوزميوم Os.
10. يتم استخدام ما يقرب من 50 عنصرًا كيميائيًا في تصنيع السيارة ، والتي يتم تضمينها في 250 مادة ومواد مختلفة.
11. يدخل الكربون والنيتروجين والأكسجين إلى النبات من الهواء. الهيدروجين والأكسجين من الماء. تدخل جميع العناصر الأخرى النبات من التربة.
12. تستخدم كبريتات النحاس والحديد والباريوم وكلوريد الزنك لحماية النباتات من الآفات والأمراض.
13. يمكنك تجميد الماء بالزئبق ، فهو يذوب عند درجة حرارة 39 درجة مئوية.
14. يعتبر كيميائيو المياه النقية نسبيًا الماء المقطر. لكنها مضرّة للجسم لأنلا توجد أملاح وغازات مفيدة فيه. يطرد الأملاح من خلايا المعدة الموجودة في عصارة الخلية.
15. تم تحديد التركيب الكيميائي الكمي للماء ، أولاً بطريقة التوليف ، ثم عن طريق التحليل ، بواسطة لافوازييه.
16. الفلور عامل مؤكسد قوي جدا. في الحالة الصلبة ، يتحد مع الهيدروجين السائل عند درجة حرارة -252 درجة مئوية.
17- يشكل السيليكون 27.6٪ من القشرة الأرضية وهو العنصر الرئيسي في المملكة من المعادن والصخور التي تتكون حصرياً من مركبات السيليكون.
18- السم القوي هو مركب الكلور مع الزئبق - كلوريد الزئبق. في الطب ، يستخدم كلوريد الزئبق كمطهر (1: 1000).
19. ترتبط أسماء هذه العناصر بالعمليات المشعة: الأستاتين ، الراديوم ، الرادون ، الأكتينيوم ، البروتكتينيوم.
هل تعرف أن...
يتطلب إنتاج 1 طن من طوب البناء 1-2 متر 3 الماء ، ولإنتاج 1 طن من الأسمدة النيتروجينية و 1 طن من النايلون - على التوالي 600 ، 2500 م 3 .
تسمى طبقة الغلاف الجوي على ارتفاع 10 إلى 50 كم طبقة الأوزون. الكمية الإجمالية لغاز الأوزون صغيرة ؛ عند الضغط العادي ودرجة الحرارة O ° C ، يتم توزيعها على سطح الأرض في طبقة رقيقة من 2-3 مم. يمتص الأوزون الموجود في الطبقات العليا من الغلاف الجوي معظم الأشعة فوق البنفسجية التي ترسلها الشمس ، ويحمي كل أشكال الحياة من آثارها المدمرة.
البولي كربونات هو بوليمر له ميزات مثيرة للاهتمام. يمكن أن يكون صلبًا مثل المعدن ، أو مرنًا مثل الحرير ، أو شفافًا مثل الكريستال ، أو ملونًا بألوان مختلفة. يمكن تشكيل البوليمر. لا يحترق ، ويحتفظ بخصائصه عند درجات حرارة من +135 إلى -150 درجة مئوية.
الأوزون سام. في التركيزات المنخفضة (أثناء العواصف الرعدية) تكون رائحة الأوزون لطيفة ومنعشة. عند تركيز أكثر من 1٪ في الهواء تكون رائحته كريهة للغاية ومن المستحيل استنشاقها.
مع التبلور البطيء ، يمكن أن يصل حجم بلورة كلوريد الصوديوم إلى أكثر من نصف متر.
يوجد الحديد النقي على الأرض فقط في شكل نيازك.
لا يمكن إطفاء حرق المغنيسيوم بثاني أكسيد الكربون ، لأنه يتفاعل معه ويستمر في الاحتراق بسبب الأكسجين المنطلق.
أكثر المعادن مقاومة للصهر هو التنجستن (ررر 3410 درجة مئوية) ، وأقل معدن انصهار هو السيزيوم (رر 28.5 درجة مئوية).
أكبر كتلة صلبة من الذهب عُثر عليها في جبال الأورال عام 1837 كانت تزن حوالي 37 كيلوجرامًا. تم العثور على كتلة صلبة من الذهب بوزن 108 كجم في كاليفورنيا ، و 250 كجم في أستراليا.
يُطلق على البريليوم اسم معدن عدم القابلية للتعب ، لأن الينابيع المصنوعة من سبائكه يمكنها تحمل ما يصل إلى 20 مليار دورة تحميل (فهي أبدية عمليًا).
حقائق وأرقام ممتعة
بدائل الفريون... كما تعلم ، فإن الفريونات والمواد الاصطناعية الأخرى التي تحتوي على الكلور والفلور تدمر طبقة الأوزون في الغلاف الجوي. وجد العلماء السوفييت بديلاً للفريون - البروبيلانات الهيدروكربونية (مركبات البروبان والبيوتان) ، وهي غير ضارة بطبقة الغلاف الجوي. بحلول عام 1995 ، ستنتج الصناعة الكيميائية مليار حاوية من الأيروسول.
TU-104 والبلاستيك. تحتوي الطائرة TU-104 على 120.000 قطعة مصنوعة من الزجاج العضوي ومواد بلاستيكية أخرى ومجموعات مختلفة منها مع مواد أخرى.
النيتروجين والبرق. حوالي 100 ضربة صاعقة كل ثانية هي أحد مصادر مركبات النيتروجين. في هذه الحالة ، تحدث العمليات التالية:
N 2 + O 2 = 2NO
2NO + O 2 = 2NO 2
2NO 2 + H 2 O + 1 / 2O 2 = 2HNO 3
وهكذا ، تدخل أيونات النترات إلى التربة ، والتي تمتصها النباتات.
الميثان والاحترار... بلغ متوسط محتوى الميثان في الغلاف الجوي السفلي (التروبوسفير) 0.0152 جزء في المليون منذ 10 سنوات. وكان ثابتًا نسبيًا. في الآونة الأخيرة ، كانت هناك زيادة منهجية في تركيزه. يؤدي ارتفاع محتوى الميثان في طبقة التروبوسفير إلى تعزيز تأثير الاحتباس الحراري ، حيث تمتص جزيئات الميثان الأشعة تحت الحمراء.
الرماد في مياه البحر... توجد أملاح الذهب المذابة في مياه البحار والمحيطات. تظهر الحسابات أن مياه جميع البحار والمحيطات تحتوي على حوالي 8 مليارات طن من الذهب. يبحث العلماء عن أكثر الطرق ربحية لاستخراج الذهب من مياه البحر. يحتوي 1 طن من مياه البحر على 0.01-0.05 ملليجرام من الذهب.
"السخام الأبيض" ... بالإضافة إلى السخام الأسود المعتاد المعروف ، هناك أيضًا "السخام الأبيض". Gak عبارة عن مسحوق من ثاني أكسيد السيليكون غير المتبلور يستخدم كحشو للمطاط في صناعة المطاط منه.
التهديد من المغذيات الدقيقة... يخلق التداول النشط للعناصر الدقيقة المتراكمة في البيئات الطبيعية ، وفقًا للخبراء ، تهديدًا خطيرًا لصحة الإنسان الحديث والأجيال القادمة. مصادرها هي ملايين الأطنان من الوقود التي يتم حرقها سنويًا ، وإنتاج الأفران العالية ، والتعدين غير الحديدية ، والأسمدة المعدنية المطبقة على التربة ، وما إلى ذلك.
مطاط شفاف.في صناعة المطاط من المطاط ، يتم استخدام أكسيد الزنك (يسرع عملية تقسية المطاط). إذا تمت إضافة بيروكسيد الزنك إلى المطاط بدلاً من أكسيد الزنك ، يكون المطاط شفافًا. من خلال طبقة من هذا المطاط بسمك 2 سم ، يمكنك قراءة الكتاب بحرية.
النفط أغلى من الذهب.تتطلب العديد من أنواع العطور زيت الورد لصنعها. إنه مزيج من المواد العطرية المستخرجة من بتلات الورد. للحصول على 1 كجم من هذا الزيت ، من الضروري جمع 4-5 أطنان من البتلات ومعالجتها كيميائيًا. سعر زيت الورد يزيد ثلاث مرات عن سعر الذهب.
الحديد بداخلنا.يحتوي جسم الشخص البالغ على 3.5 غرام من الحديد. هذا صغير جدًا مقارنة ، على سبيل المثال ، بالكالسيوم الذي يزيد عن 1 كجم في الجسم. لكن إذا قارنا ليس المحتوى الكلي لهذه العناصر ، ولكن تركيزها في الدم فقط ، فإن الحديد هنا يزيد بخمس مرات عن الكالسيوم. يتركز الجزء الأكبر من الحديد الذي يمثل جزءًا من الجسم (2.45 جم) في كريات الدم الحمراء في الدم. يوجد الحديد في بروتين العضلات والميوجلوبين وفي العديد من الإنزيمات. 1٪ من الحديد يدور باستمرار في البلازما - الجزء السائل من الدم. يعتبر الكبد "المستودع" الرئيسي للحديد: حيث يمكن للرجل البالغ أن يخزن ما يصل إلى 1 غرام من الحديد. هناك تبادل مستمر بين جميع الأنسجة والأعضاء التي تحتوي على الحديد. يجلب الدم حوالي 10٪ من الحديد إلى نخاع العظام. إنه جزء من الصبغة التي تصبغ الشعر.
الفوسفور عنصر من عناصر الحياة والفكر... يتركز الفسفور في الحيوانات بشكل رئيسي في الهيكل العظمي والعضلات والأنسجة العصبية. يحتوي جسم الإنسان في المتوسط على حوالي 1.5 كجم من الفوسفور. من هذه الكتلة ، 1.4 كيلوغرام من العظام ، وحوالي 130 غراماً بالعضلات ، و 12 غراماً بالأعصاب والدماغ. ترتبط جميع العمليات الفسيولوجية التي تحدث في أجسامنا تقريبًا بتحولات مواد الفوسفور العضوي.
بحيرة الأسفلت... في جزيرة ترينيداد في مجموعة جزر الأنتيل الصغرى ، توجد بحيرة مليئة ليس بالمياه ، ولكن بالإسفلت المتجمد. تبلغ مساحتها 45 هكتارًا ، ويصل عمقها إلى 90 مترًا ، ويُعتقد أن البحيرة تشكلت في فوهة بركان ، تغلغل فيها النفط عبر الشقوق الجوفية. وقد تم بالفعل استخراج ملايين الأطنان من الأسفلت منه.
السبائك الدقيقة.تعد السبائك الدقيقة إحدى المشكلات المركزية لعلوم المواد الحديثة. من خلال إدخال كميات صغيرة (حوالي 0.01٪) من بعض العناصر ، من الممكن تغيير خصائص السبائك بشكل كبير. هذا بسبب الفصل ، أي تكوين تركيز مفرط لعناصر صناعة السبائك على العيوب الهيكلية.
أنواع الفحم. "فحم عديم اللون"- هذا غاز ، "فحم أصفر" - طاقة شمسية ، "فحم أخضر" - وقود نباتي ، "فحم أزرق" - طاقة مد وجزر البحار ، "الفحم الأزرق" - القوة الدافعة للرياح ، " الفحم الأحمر "- طاقة البراكين.
الألمنيوم الأصلي.أثارت الاكتشافات الحديثة للألمنيوم المعدني الأصلي مسألة طرق تكوينه. وفقًا للعلماء ، في الذوبان الطبيعي تحت تأثير التيارات الكهربية (التيارات الكهربائية المتدفقة في قشرة الأرض) ، يحدث الاختزال الكهروكيميائي للألمنيوم.
مسمار بلاستيك.البلاستيك - ثبت أن البولي كربونات مناسب لصناعة المسامير. يتم دفع المسامير منهم بحرية في اللوحة ولا تفعل ذلكالصدأ ، وفي كثير من الحالات يحل محل المسامير الحديدية تمامًا.
حامض الكبريتيك في الطبيعة... يتم الحصول على حامض الكبريتيك علىنباتات كيميائية. اتضح أنه يتشكل في الطبيعة ، في المقام الأول في البراكين. على سبيل المثال ، في مياه نهر ريو نيغرو ، الذي ينشأ من بركان Puracho في أمريكا الجنوبية ، في فوهة البركان الذي يتكون من الكبريت ، يحتوي على ما يصل إلى0.1٪ حامض كبريتيك. ينقل النهر ما يصل إلى 20 لترًا من حمض الكبريتيك "البركاني" إلى البحر يوميًا. في اتحاد الجمهوريات الاشتراكية السوفياتية ، اكتشف الأكاديمي فيرسمان حامض الكبريتيك في رواسب الكبريت في صحراء كاراكوم.
الادمان ألعاب الكيمياء
من هو أسرع وأكثر؟يدعو المعلم المشاركين في اللعبة إلى كتابة أسماء العناصر التي تنتهي بالحرف نفسه ، على سبيل المثال ، في "n" (الأرجون ، الكريبتون ، الزينون ، اللانثانوم ، الموليبدينوم ، النيون ، الرادون ، إلخ). يمكن جعل اللعبة أكثر صعوبة من خلال عرض العثور على هذه العناصر في الجدول
D.I. Mendeleev وبيان أي منها معادن وأيهاغير المعادن.
اكتب أسماء العناصر.يدعو المعلم الطالب إلى السبورة ويدعوه لكتابة عدد من المقاطع. يقوم باقي الطلاب بتدوينها في دفاتر الملاحظات. التخصيص: في 3 دقائق ، قم بتكوين الأسماء المحتملة للعناصر من المقاطع المكتوبة. على سبيل المثال ، من المقاطع اللفظية "se، tiy، diy، ra، lion، li" يمكنك تكوين الكلمات: "ليثيوم ، كبريت ، راديوم ، سيلينيوم".
رسم معادلات التفاعلات."من يعرف كيف يصنع بسرعة معادلات التفاعلات ، على سبيل المثال ، بين المعدن والأكسجين؟ - يسأل المعلم مشيراً إلى المشاركين في اللعبة - اكتب معادلة تفاعل أكسدة الألومنيوم. من يكتب المعادلة أولا ، فليرفع يده ".
من يعرف أكثر؟يغلق المعلم شريط الورق على الطاولة
تدعو DI Mendeleev مجموعة من العناصر (أو فترة) وواحدة تلو الأخرى الفرق إلى تسمية وكتابة علامات عناصر مجموعة مغلقة (أو فترة). الفائز هو الطالب الذي يسمي المزيد من العناصر الكيميائية ويكتب علاماتها بشكل صحيح.
معنى أسماء العناصر في الترجمة من لغة أجنبية.ماذا تعني كلمة "بروم" في الترجمة من اللغة اليونانية؟ يمكنك أيضًا لعب نفس اللعبة للمشاركين لمعرفة معنى أسماء العناصر في الترجمة من اللغة اللاتينية (على سبيل المثال ، الروثينيوم ، التيلوريوم ، الغاليوم ، الهافنيوم ، اللوتيتيوم ، الهولميوم ، إلخ).
اسم الصيغة. يقوم المعلم بتسمية مركب ، على سبيل المثال ، هيدروكسيد المغنيسيوم. ينفد اللاعبون ، الذين توجد في أيديهم أجهزة لوحية مع صيغ ، حاملين جهازًا لوحيًا مع الصيغة المقابلة في أيديهم.
الحزورات ، والألغاز ،
الكلمات المتقاطعة والكلمات المتقاطعة.
1 ... تشير الأحرف الأربعة الأولى من لقب الفيلسوف اليوناني الشهير إلى كلمة "شعب" في اليونانية بدون الحرف الأخير ، أما الأحرف الأربعة الأخيرة فهي جزيرة في البحر الأبيض المتوسط ؛ بشكل عام - اسم الفيلسوف اليوناني ، مؤسس النظرية الذرية.(ديموس ، كريت - ديموقريطس).
2. المقطع الأول لاسم عنصر كيميائي هو أيضًا أول مقطع من اسم أحد عناصر مجموعة البلاتين ؛ بشكل عام ، إنه معدن حصلت عليه ماريا سكلودوفسكا كوري على جائزة نوبل.(الرادون والروديوم والراديوم.)
3. المقطع الأول من اسم العنصر الكيميائي هو أيضًا المقطع الأول في اسم "العنصر القمري" ؛ والثاني هو الأول باسم المعدن الذي اكتشفه M. Sklodowska-Curie ؛ بشكل عام - إنها (في اللغة الخيميائية) "صفراء الإله فولكان".(السيلينيوم والراديوم - الكبريت).
4. المقطع الأول من الاسم هو أيضًا المقطع الأول لاسم الغاز الخانق الناتج عن تخليق أول أكسيد الكربون (II) والكلور ؛ المقطع الثاني هو الأول باسم محلول الفورمالديهايد في الماء ؛ بشكل عام ، إنه عنصر كيميائي ، كتب عنه أ.إ. فيرسمان أنه عنصر من عناصر الحياة والفكر.(فوسجين ، فورمالين- الفوسفور.)
لن يجادل شخص واحد ، حتى في أدنى درجة على دراية بمشاكل التعليم الحديث ، حول مزايا النظام السوفيتي. ومع ذلك ، كان لديها أيضًا بعض أوجه القصور ، على وجه الخصوص ، في دراسة موضوعات العلوم الطبيعية ، وغالبًا ما يتم التركيز على توفير عنصر نظري ، وتم إبعاد الممارسة إلى الخلفية. في الوقت نفسه ، سيؤكد أي معلم أن أفضل طريقة لإثارة الاهتمام بهذه الموضوعات لدى الطفل هي إظهار نوع من الخبرة الفيزيائية أو الكيميائية المذهلة. هذا مهم بشكل خاص في المرحلة الأولى من دراسة مثل هذه الموضوعات وحتى قبل ذلك بوقت طويل. في الحالة الثانية ، يمكن أن تكون مجموعة أدوات خاصة للتجارب الكيميائية ، والتي يمكن استخدامها في المنزل ، مساعدة جيدة للآباء. صحيح ، عند الحصول على مثل هذه الهدية ، يجب على الآباء والأمهات أن يفهموا أنه سيتعين عليهم أيضًا المشاركة في الفصول الدراسية ، لأن مثل هذه "اللعبة" في يد طفل ترك دون مراقبة تشكل خطراً معيناً.
ما هي التجربة الكيميائية
بادئ ذي بدء ، تحتاج إلى معرفة ما يدور حوله. من المقبول عمومًا أن التجربة الكيميائية هي معالجة العديد من المواد العضوية وغير العضوية من أجل تحديد خصائصها وتفاعلاتها في ظل ظروف مختلفة. إذا كنا نتحدث عن التجارب التي يتم إجراؤها بهدف إثارة رغبة الطفل في دراسة العالم من حوله ، فيجب أن تكون مذهلة وفي نفس الوقت بسيطة. بالإضافة إلى ذلك ، لا يوصى بتحديد الخيارات التي تتطلب تدابير أمنية خاصة.

من أين نبدأ
بادئ ذي بدء ، يمكنك إخبار طفلك أن كل ما يحيط بنا ، بما في ذلك جسده ، يتكون من مواد مختلفة تتفاعل. نتيجة لذلك ، يمكن ملاحظة ظواهر مختلفة: سواء تلك التي اعتاد الناس عليها منذ فترة طويلة ولا ينتبهون لها ، وغير عادية للغاية. في هذه الحالة ، كمثال ، يمكننا الاستشهاد بالصدأ الناتج عن أكسدة المعادن ، أو الدخان من النار ، وهو غاز ينطلق عند احتراق أشياء مختلفة. بعد ذلك ، يمكنك البدء في عرض تجارب كيميائية بسيطة.

"تطفو البيض"
يمكن عرض تجربة شيقة للغاية باستخدام بيضة ومحلول مائي من حمض الهيدروكلوريك. لتنفيذه ، يجب أن تأخذ دورق زجاجي أو كوبًا عريضًا وصب محلول حمض الهيدروكلوريك بنسبة 5٪ في القاع. ثم تحتاج إلى خفض البيضة فيه وانتظر بعض الوقت.
قريباً على سطح قشر البيض ، بسبب تفاعل حمض الهيدروكلوريك وكربونات الكالسيوم الموجودة في القشرة ، ستظهر فقاعات من ثاني أكسيد الكربون وترفع البيضة للأعلى. بعد أن وصلت إلى السطح ، سوف تنفجر فقاعات الغاز ، وسيذهب "الحمل" مرة أخرى إلى قاع الطبق. ستستمر عملية تربية وغوص البيض حتى تذوب جميع قشور البيض في حمض الهيدروكلوريك.
"اللافتات السرية"
يمكن إجراء تجارب كيميائية مثيرة للاهتمام مع حامض الكبريتيك. على سبيل المثال ، باستخدام قطعة قطن مغموسة في محلول 20٪ من حامض الكبريتيك ، يرسمون أشكالًا أو أحرفًا على الورق وينتظرون حتى يجف السائل. ثم يتم تسويتها بالحديد الساخن وتبدأ الحروف السوداء في الظهور. ستكون هذه التجربة أكثر فاعلية إذا وضعت الورقة فوق شعلة الشمعة ، ولكن يجب أن يتم ذلك بحذر شديد ، مع الحرص على عدم إشعال النار في الورقة.
"نقش ناري"
يمكن إجراء الخبرة السابقة بطريقة مختلفة. للقيام بذلك ، ارسم كفافًا لأي شكل أو حرف على ورقة بقلم رصاص وقم بإعداد تركيبة تتكون من 20 جم من KNO 3 مذابة في 15 مل من الماء الساخن. ثم باستخدام فرشاة ، انقع الورقة على طول خطوط القلم الرصاص بحيث لا توجد فجوات. بمجرد أن يصبح الجمهور جاهزًا ، والورقة جافة ، تحتاج إلى إحضار الشظية المحترقة إلى النقش في نقطة واحدة فقط. ستظهر شرارة على الفور ، والتي "ستسير" على طول محيط الرسم حتى تصل إلى نهاية الخط.
بالتأكيد سيهتم القليل من المشاهدين بالسبب وراء تحقيق هذا التأثير. اشرح أنه عند تسخينها ، تتحول نترات البوتاسيوم إلى مادة أخرى ، نتريت البوتاسيوم ، وتطلق الأكسجين لدعم الاحتراق.

"منديل مقاوم للحريق"
سيهتم الأطفال بالتأكيد بتجربة القماش "المقاوم للحريق". لإثبات ذلك ، قم بإذابة 10 جم من غراء السيليكات في 100 مل من الماء وقم بترطيب قطعة قماش أو منديل بالسائل الناتج. ثم يتم عصره بالخارج وغمره بالملاقط في وعاء به أسيتون أو بنزين. أشعل النار على الفور في القماش باستخدام شظية ولاحظ كيف "يلتهم" اللهب الوشاح ، لكنه يظل سليماً.
الباقة الزرقاء
يمكن أن تكون تجارب الكيمياء البسيطة مذهلة للغاية. نقترح عليك أن تفاجئ المشاهد باستخدام أزهار ورقية ، يجب طلاء بتلاتها بغراء مصنوع من النشا الطبيعي. ثم يجب وضع الحزمة في جرة ، وتقطير بضع قطرات من صبغة كحول اليود في الأسفل وإغلاق الغطاء بإحكام. في غضون بضع دقائق ، ستحدث "معجزة": ستتحول الأزهار إلى اللون الأزرق حيث يتسبب بخار اليود في تغيير لون النشا.
"زينة عيد الميلاد"
سيتم الحصول على تجربة كيميائية أصلية ، ونتيجة لذلك سيكون لديك زينة جميلة لشجرة عيد الميلاد الصغيرة ، إذا كنت تستخدم محلول مشبع (1:12) من شب البوتاسيوم KAl (SO 4) 2 مع إضافة النحاس كبريتات CuSO 4 (1: 5).
أولاً ، تحتاج إلى عمل إطار للتمثال من السلك ، ولفه بخيوط صوفية بيضاء وخفضها في الخليط المُعد مسبقًا. بعد أسبوع أو أسبوعين ، تنمو البلورات على قطعة العمل ، والتي يجب تلميعها بالورنيش حتى لا تنهار.

"البراكين"
يمكن الحصول على تجربة كيميائية فعالة للغاية باستخدام صفيحة وطين وصودا الخبز والخل والصبغة الحمراء وسائل غسيل الأطباق. بعد ذلك ، عليك المتابعة على النحو التالي:
- قسّم قطعة من البلاستيسين إلى جزأين ؛
- لف واحدة في فطيرة مسطحة ، ومن القالب الثاني مخروط مجوف ، في الجزء العلوي منه تحتاج إلى ترك حفرة ؛
- ضع المخروط على قاعدة من البلاستيسين وقم بتوصيله بحيث لا يسمح "البركان" بمرور الماء ؛
- ضع الهيكل على صينية
- صب "الحمم البركانية" ، تتكون من 1 ملعقة كبيرة. ل. صودا الخبز وبضع قطرات من ألوان الطعام السائلة ؛
- عندما يكون الجمهور جاهزًا ، اسكب الخل في "الفم" وشاهد التفاعل العنيف ، والذي يتم خلاله إطلاق ثاني أكسيد الكربون ، وتتدفق الرغوة الحمراء من البركان.
كما ترون ، يمكن أن تكون التجارب الكيميائية المنزلية شديدة التنوع ، ولن تهمهم جميعًا الأطفال فحسب ، بل الكبار أيضًا.
أمسية ترفيهيّة في الكيمياء
عند التحضير لأمسية كيميائية ، يلزم إعداد المعلم بعناية لإجراء التجارب.
يجب أن يسبق الأمسية عمل طويل ودقيق مع الطلاب ، ولا ينبغي تكليف طالب واحد بأكثر من تجربتين.
الغرض من المساء الكيميائي- تكرار المعرفة المكتسبة لتعميق اهتمام الطلاب بالكيمياء وغرس المهارات العملية في تصميم التجارب وتنفيذها.
وصف المراحل الرئيسية لأمسية كيميائية مسلية
ط- كلمة تعريفية للمعلم في موضوع "دور الكيمياء في حياة المجتمع".
ثانيًا. تجارب مسلية في الكيمياء.
القائد (يقوم بدور القائد أحد طلاب الصف 10-11):
اليوم لدينا أمسية مسلية للكيمياء. مهمتك هي متابعة التجارب الكيميائية عن كثب ومحاولة شرحها. وهكذا ، نبدأ! تجربة رقم 1: "بركان".
رقم التجربة 1. الوصف:
يقوم أحد المشاركين في المساء بصب مسحوق ثنائي كرومات الأمونيوم المسحوق (على شكل شريحة) على شبكة من الأسبستوس ، ويضع عدة رؤوس من أعواد الثقاب في الجزء العلوي من الشريحة ويضعها على النار بشظية.
ملحوظة: سيبدو البركان أكثر إثارة للإعجاب إذا أضفت القليل من المغنيسيوم المسحوق إلى ثنائي كرومات الأمونيوم. تخلط مكونات الخليط على الفور ، لأن يحترق المغنيسيوم بشدة ووجوده في مكان واحد يسبب تشتت الجزيئات الساخنة.
جوهر التجربة هو التحلل الطارد للحرارة لثاني كرومات الأمونيوم بالتسخين الموضعي.
لا يوجد دخان بدون نار - يقول مثل روسي قديم. اتضح أنه بمساعدة الكيمياء يمكنك الحصول على دخان بدون نار. وهكذا ، الاهتمام!
التجربة رقم 2. الوصف:
يأخذ المشارك في المساء قضيبين زجاجيين ، يُلف عليهما القليل من الصوف القطني ، ويرطبهما: أحدهما في حمض النيتريك (أو الهيدروكلوريك) المركز ، والآخر في محلول أمونيا مائي بنسبة 25٪. يجب إحضار العصي لبعضها البعض. دخان أبيض يتصاعد من العصي.
جوهر التجربة هو تكوين نترات الأمونيوم (كلوريد).
والآن نقدم لكم التجربة التالية - "ورق التصوير".
رقم التجربة 3. الوصف:
يقوم أحد المشاركين في المساء بإخراج قطع من الورق على لوح من الخشب الرقائقي ، ولمسها بقضيب زجاجي. عندما تلمس كل ورقة ، تسمع طلقة.
ملاحظة: يتم قطع شرائح ضيقة من ورق الترشيح مقدمًا وترطيبها في محلول من اليود في الأمونيا. بعد ذلك ، توضع الشرائط على لوح من الخشب الرقائقي وتترك لتجف حتى المساء. كانت اللقطة أقوى ، كلما كان الورق مشبعًا بالمحلول بشكل أفضل وكلما كان محلول يوديد النيتروجين أكثر تركيزًا.
جوهر التجربة هو التحلل الطارد للحرارة للمركب الهش NI3 * NH3.
لدي بيضة. من منكم يا رفاق سيقشرها دون أن يكسر القشرة؟
رقم التجربة 4. الوصف:
يضع المشارك في المساء بيضة في بلورة بمحلول حمض الهيدروكلوريك (أو الخليك). بعد فترة ، أخرج بيضة مغطاة بغشاء القشرة فقط.
جوهر التجربة - تحتوي القشرة بشكل أساسي على كربونات الكالسيوم. في حمض الهيدروكلوريك (الخليك) ، يتحول إلى كلوريد الكالسيوم القابل للذوبان (أسيتات الكالسيوم).
يا رفاق ، في يدي تمثال لرجل مصنوع من الزنك. دعونا نلبسه.
التجربة رقم 5. الوصف:
يقوم المشارك في المساء بغمر التمثال في محلول 10٪ من أسيتات الرصاص. التمثال مغطى بطبقة رقيقة من بلورات الرصاص تذكرنا بملابس الفراء.
جوهر التجربة هو أن المعدن الأكثر نشاطًا يضغط على المعدن الأقل نشاطًا من المحاليل الملحية.
يا رفاق هل يمكن حرق السكر بدون نار؟ دعونا تحقق!
رقم التجربة 6. الوصف:
يصب أحد المشاركين في المساء سكرًا ناعمًا (30 جم) في كوب يوضع على صحن ، ويصب 26 مل من حمض الكبريتيك المركز في نفس الزجاج ويخلط الخليط بقضيب زجاجي. بعد 1-1.5 دقيقة ، يغمق الخليط في الزجاج ويتضخم ويرتفع فوق حواف الزجاج في شكل كتلة فضفاضة.
جوهر التجربة هو أن حامض الكبريتيك يأخذ الماء من جزيئات السكر ، ويؤكسد الكربون في ثاني أكسيد الكربون ، وفي نفس الوقت يتشكل الغاز الكبريت. تدفع الغازات المتصاعدة الكتلة إلى خارج الزجاج.
ما هي طرق إشعال النار التي تعرفها؟
يتم إعطاء أمثلة من الجمهور.
دعونا نحاول الاستغناء عن هذه الأدوات.
التجربة رقم 7. الوصف:
يصب أحد المشاركين في المساء برمنجنات البوتاسيوم (6 جم) في مسحوق على قطعة من القصدير (أو البلاط) ويسقط الجلسرين من ماصة عليه. بعد فترة ، تظهر نار.
جوهر التجربة - نتيجة التفاعل ، يتم إطلاق الأكسجين الذري وإشعال الجلسرين.
حفلة اخرى في المساء:
سأشعل النار أيضًا بدون مباريات ، ولكن بطريقة مختلفة فقط.
رقم التجربة 8. الوصف:
يصب أحد المشاركين في المساء كمية صغيرة من بلورات برمنجنات البوتاسيوم على قطعة من الطوب ويقطر حامض الكبريتيك المركز عليها. حول هذا الخليط ، يقوم بطي رقائق رقيقة على شكل نار ، ولكن حتى لا تلمس الخليط. ثم يبلل قطعة صغيرة من القطن بالكحول ويمسك بيده فوق النار ويخرج بضع قطرات من الكحول من الصوف القطني حتى تسقط على الخليط. تضيء النار على الفور.
جوهر التجربة هو أن الكحول يتأكسد بقوة مع الأكسجين ، والذي يتم إطلاقه أثناء تفاعل حمض الكبريتيك مع برمنجنات البوتاسيوم. تؤدي الحرارة المنبعثة خلال هذا التفاعل إلى إشعال النار.
والآن الأضواء المذهلة!
التجربة رقم 9. الوصف:
يضع المشارك في المساء أعواد قطنية مبللة بالكحول الإيثيلي في أكواب خزفية. على سطح السدادات القطنية ، يصب الأملاح التالية: كلوريد الصوديوم ، نترات السترونشيوم (أو نترات الليثيوم) ، كلوريد البوتاسيوم ، نترات الباريوم (أو حمض البوريك). على قطعة من الزجاج ، يقوم المشارك بإعداد خليط (عصيدة) من برمنجنات البوتاسيوم وحمض الكبريتيك المركز. يأخذ بعضًا من هذه الكتلة بقضيب زجاجي ويلامس سطح السدادات القطنية. تومض وتحترق السدادات القطنية بألوان مختلفة: الأصفر ، الأحمر ، البنفسجي ، الأخضر.
جوهر التجربة - أيونات المعادن الأرضية القلوية والقلوية ترسم اللهب بألوان مختلفة.
أعزائي الرجال ، أنا متعب وجائع جدًا لدرجة أنني أطلب منكم السماح لي بتناول القليل من الطعام.
رقم التجربة 10. الوصف:
يخاطب المقدم المشارك في المساء:
من فضلك أعطني الشاي والبسكويت.
أحد المشاركين في المساء يعطي للمضيف كأسًا من الشاي والمفرقعات البيضاء.
يقوم المقدم بترطيب البسكويت في الشاي - يتحول لون البسكويت إلى اللون الأزرق.
قيادة :
عار ، لقد سممتني تقريبا!
حفلة المساء:
معذرةً ، لابد أنني أربكت النظارات.
كان جوهر التجربة هو وجود محلول اليود في الزجاج. تحول النشا في البسكويت إلى اللون الأزرق.
يا رفاق ، تلقيت خطابًا ، لكن كان هناك ورقة فارغة في الظرف. من يمكنه مساعدتي في معرفة ما هو الأمر؟
رقم التجربة 11. الوصف:
طالب من الجمهور (مُعد مسبقًا) يلمس شظية مشتعلة بعلامة قلم رصاص على ورقة. تحترق الورقة ببطء على طول خط الرسم والضوء ، متحركًا على طول محيط الصورة ، يحددها (يمكن أن يكون الرسم تعسفيًا).
جوهر التجربة - الورق يحترق بسبب أكسجين النترات الذي تبلور في سمكه.
ملاحظة: تم تطبيق الرسم مسبقًا على ورقة بمحلول قوي من نترات البوتاسيوم. يجب أن يتم تطبيقه في خط واحد مستمر بدون تقاطعات. من مخطط الرسم بنفس الحل ، ارسم خطًا على حافة الورقة ، مع وضع علامة على نهايته بقلم رصاص. عندما يجف الورق ، سيكون التصميم غير مرئي.
الآن ، يا رفاق ، دعنا ننتقل إلى الجزء الثاني من أمسيتنا. ألعاب الكيمياء!
ثالثا. ألعاب الفريق.
المشاركون في المساء مدعوون للانقسام إلى مجموعات. كل مجموعة تشارك في اللعبة المقترحة.
لعبة رقم 1. لوتو الكيميائية.
تتم كتابة صيغ المواد الكيميائية على بطاقات ، كما هو الحال في لوتو عادي ، وأسماء هذه المواد مكتوبة على مربعات من الورق المقوى. يتم منح أعضاء المجموعة بطاقات ، ويقوم أحدهم بسحب المربعات وتسمية المواد. الفائز هو عضو المجموعة وهو أول من قام بتغطية جميع حقول البطاقة.
لعبة رقم 2. مسابقة كيميائية.
يتم سحب حبل بين ظهر كرسيين. الحلوى مربوطة به على خيوط مربوطة بقطع من الورق بها أسئلة. يتناوب أعضاء المجموعة على قطع الحلوى بالمقص. يصبح اللاعب صاحب الحلوى بعد الإجابة على السؤال المرفق بها.
أعضاء المجموعة يشكلون دائرة. هم يحملون علامات وأرقام كيميائية في أيديهم. اثنان من اللاعبين في منتصف الدائرة. بناءً على الأمر ، يقومون بتكوين صيغة كيميائية للمواد من العلامات والأرقام التي يحملها باقي اللاعبين. الفائز هو المشارك الذي يرسم الصيغة بشكل أسرع.
ينقسم أعضاء المجموعة إلى فريقين. يتم إعطاؤهم بطاقات تحتوي على صيغ وأرقام كيميائية. عليهم تكوين معادلة كيميائية. يفوز الفريق الأول الذي شكل المعادلة.
تنتهي الأمسية بمنح جوائز للمشاركين الأكثر نشاطاً.